 |
Нахождение оптимальных условий реагентного умягчения воды методом декарбонизации
|
|
|
|
Механизм процесса реагентного умягчения воды с применением извести, соды и едкого натра
Процесс образования осадка при умягчении воды реагентными методами проходит в две фазы:
I – я фаза: заключается в собственно химической реакции взаимодействия ионов с образованием малорастворимых соединений СаСО3 и Мg(ОН)2. Эта фаза протекает практически мгновенно.
II – я фаза: является процессом кристаллизации вещества образующегося осадка СаСО3 и образования хлопьев Mg(OH)2.
Лимитирующей стадией процесса умягчения воды является II – я фаза – т.е. стадия кристаллизации труднорастворимых соединений.
Для интенсификации процесса умягчения воды применяют следующие способы:
1. подогрев воды – растворимость СаСО3, Mg(OH) с увеличением температуры уменьшается;
2. добавление избытка реагента осадителя и коагулянта;
3. создание контакта умягчаемой воды с ранее образовавшимся осадком.
Каким образом влияет подогрев воды на остаточную жёсткость видно из следующего графика:

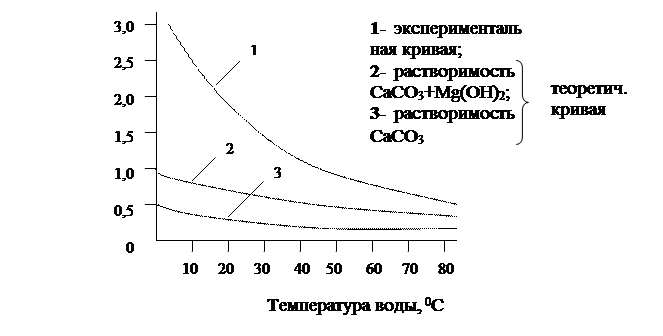
Из графика следует, что с увеличением температуры остаточная жёсткость уменьшается. Это обусловлено уменьшением растворимости СаСО3 и Мg(ОН)2, а так же ускорением и более полным прохождением реакции.
Поэтому на практике часто применяют подогрев воды до температуры 35-400С, а если требуется ещё более глубокое умягчение, то процесс проводят при температуре 1000С.
Рассмотрим каким образом влияет доза извести на остаточную жёсткость воды:

или при наличие в воде магниевой некарбонатной жёсткости вследствие её перехода в кальциевую жёсткость по уравнению:
MgSO4 + Ca(OH)2 → ↓ Mg(OH) 2 + CaSO4
В связи с этим избыток извести не рекомендуется принимать более 0,5 мг-экв/л.
|
|
|
При известково-содовом методе также не рекомендуется принимать большие избытки извести. Хотя при этом методе они не вызывают увеличение остаточной жёсткости вследствие реакции:
Ca (OH)2 + Na 2 CO 3 → ↓ CaCO 3 + 2 NaOH
Однако избыточные дозы извести приводят к нерациональному перерасходу соды.
Каким образом влияет избыток соды на остаточную жёсткость???
Рассмотрим следующий график:
|


Частицы осадка способствуют ускорению кристаллизации (СаСО3) и агломерации в крупные хлопья (Мg(ОН)2), образующиеся при умягчении воды СаСО3 и Мg(ОН)2.
Осуществление такого контакта производят при пропуске воды через слой взвешенного осадка в осветлителях.
Нахождение оптимальных условий реагентного умягчения воды методом декарбонизации
Теоретическим пределом умягчения природной воды декарбонизацией составляет при:
00С – 0,55 мг-экв/л (11 мг/л Са2+)
800С – 0,23 мг-экв/л (5 мг/л Са2+)
Фактически растворимость СаСО3 и Мg(ОН)2 в природной воде зависит от ионного состава воды и в первую очередь от содержания в воде ионов СО32- и ОН-.
Одним из возможных методов контроля правильности процесса обработки воды (т.е. дозирования реагентов) является наблюдение за величиной рН после введения в воду реагентов.
При этом необходимо знать равновесное значение рН образования соединений СаСО3 и Мg(ОН)2.
Эту величину обозначают рНS. Однако, при рН S образование этих соединений хотя и происходит наиболее полно, но в то же время - медленно, т.е. процесс растянут во времени.
Для того чтобы обеспечить теоретический предел умягчения в течение практически приемлемого промежутка времени, необходим некоторый избыток ионов ОН-. Достаточная величина рН для протекания реакции с нужной скоростью (рНн) будет определяться суммой 2-х величин:
рНН = рН S + ∆рН (1)
|
|
|
Сразу же отметим, что избыток ионов ОН- должен быть тем больше, чем ниже температура воды и чем выше содержание в воде органических веществ, мешающих процессу умягчения воды т.к. органические вещества приостанавливают укрупнение коллоидных соединений, образующихся в результате добавления реагентов.
Установлено, что величина рН равновесного насыщения воды СаСО3 и Мg(ОН)2 к концу процесса умягчения воды или величина рНS в уравнении (1) для данных труднорастворимых соединений является функцией ряда параметров.
Например, для гидроксида Mg и карбоната Са, величина рНS зависит соответственно от следующих факторов:
рН S Mg ( OH ) 2 = f 1 (t) + f 2 (Mg 2+) + f 3 (P) (2)
рН S CaCO 3 = f1(t) + f2(Ca2+) + f3(P) – f4(Щ) (3)
где f1(t) – функциональная зависимость рНS соответственно для СаСО3 и Мg(ОН)2 от температуры воды;
f2(Са2+ и Мg2+) – зависимость искомой величины от концентрации в воде ионов С а2+ и М g 2 +;
f3(P) – зависимость рНS от солесодержания умягчаемой воды;
f4(Щ) – влияние щёлочности обрабатываемой воды на рНS СаСО3.
Для облегчения расчётов по формулам (2) и (3) составлены специальные графики, которые имеются в учебниках и справочниках, на каждом из которых слева нанесены соответственно, температура воды, концентрации катионов Са2+ и Мg2+, общее солесодержание, а справа – численные значения функций этих величин.
Например, необходимо определить величину рН равновесного насыщения воды Мg(ОН)2, при которой в процессе умягчения воды может быть достигнута остаточная концентрация Мg2+ = 4 мг/л, температура воды 350С, общее солесодержание 70 мг/л.
Соответственно по графику находим:
рН S Mg ( OH ) 2 = f 1 (t) + f 2 (Mg 2+) + f 3 (P) = 8,29 + 1,87 + 0,01≈ 10,2
для обеспечения нужной для практики скорости протекания реакции удаления из воды Mg в виде Мg(ОН)2 нужен избыток в растворе ОН- ионов.
Принимаем ∆рН= 0,7.
Тогда рНН = 10,2 + 0,7 = 10,9
А для эффективного удаления из воды СаСО3 в условиях, приведённых выше, рНН должен быть = 9,6.
|
|
|
|
|
|


