 |
Механизм альдольно-кротоновой кондесации в кислой среде
|
|
|
|
Органічна хімія
(інформаційні матеріали)
Модуль 2.1.
Карбонильные соединения
Таблица 1. Примеры номенклатуры альдегидов

Таблица 2. Свойства некоторых альдегидов и кетонов

Некоторые методы получения альдегидов и кетонов

4. Химические свойства карбонильных соединений
1. Реакции нуклеофильного присоединения AN. В качестве нуклеофилов могут выступать: H2O, ROH, HCN, NaHSO3, RMgI. Реакция с NaHSO3 является качественной на альдегиды и метилкетоны – выпадает кристаллический осадок.

2. Реакции нуклеофильного замещения кислорода карбонильной группы на азот N-нуклеофилами. В качестве N-нуклеофилов могут выступать NH3 (аммиак), RNH2 (амины), NH2OH (гидроксиламин), NH2NH2 (гидразин), NH2NH-C6H5 (фенилгидразин), NH2NHCONH2 (семикарбазид), NH2NHCSNH2 (тиосемикарбазид).

3. Реакции конденсации – реакции присоединения или замещения атома кислорода карбонильной группы, приводящие к образованию новой углерод-углеродной связи. В реакции участвуют карбонильная компонента – субстрат, в роли которого может быть альдегид или кетон, и метиленовая компонента – реагент, в роли которого может быть С-Н кислота: альдегиды, кетоны, сложные эфиры, ангидриды кислот и нитросоединения. Если в реакции конденсации участвуют альдегиды или кетоны, то называют такую реакцию альдольно-кротоновой конденсацией.

Например, уксусный альдегид на холоду при действии разбавленных растворов щелочей превращается в альдоль; при проведении реакции в более жестких условиях (при нагревании) альдоль дегидратируется с образованием кротонового альдегида:
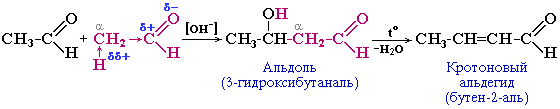
Легкое отщепление воды от альдоля объясняется подвижностью водородного атома в α-положении к карбонильной и гидрокси-группе (на него действуют –I-эффекты обоих групп: С=О и -ОН)
|
|
|
Впервые эти реакции осуществили одновременно (1872 г.) и независимо друг от друга А.П.Бородин и Ш.А.Вюрц.
4. Реакции окисления альдегидов протекают в мягких условиях с образованием карбоновых кислот. Реакции «серебряного зеркала» и окисление гидроксидом меди являются качественными на альдегидную группу.

Кетоны окисляются в более жестких условиях, реакции идут с разрывом углерод-углеродной связи: Правило Попова: окисление несимметричных ациклических кетонов осуществляется с разрывом углеродной цепи по обе стороны от карбонильной группы, что приводит в общем случае к образованию смеси четырех к-т:

ацетон пропановая к-та изобутановая к-та этановая к-та
5. Реакции восстановления альдегидов приводят к образованию первичных спиртов, кетонов – вторичных спиртов. В качестве восстановителей могут использоваться Н2 / Ni; NaBH4, LiAlH4.

6. Реакции окисления-восстановления (диспропорционирования) - реакция Канниццаро, характерна для альдегидов, не содержащих при α-атоме углерода водородных атомов. Одна молекула альдегида восстанавливается в спирт за счет окисления второй молекулы в кислоту:

Механизм на примере формальдегида:

7. Реакции по углеводородному заместителю:
а) галоформная реакция – качественная реакция для метилкетонов и уксусного альдегида – выпадает желтый осадок иодоформа:

б) реакции по ароматическому циклу. Карбонильная группа относится к заместителям II рода (мета -ориентантам), т. е. замещение водорода бензольного цикла на электрофил происходит в мета- положении (и в более жестких условиях, чем в бензоле).

Механизм енолизации, катализируемой кислотой
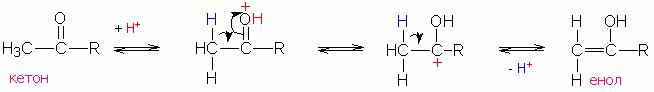
Механизм енолизации, катализируемой основанием

Механизм альдольно-кротоновой кондесации в кислой среде
|
|
|
Сначала протекает енолизация метиленовой компоненты и протонирование карбонильной компоненты:

В конденсацию вступают енол (метиленовая компонента) и протонированная карбонильная группа второй молекулы соединения (карбонильная компонента):

|
|
|


