 |
Задания и методические указания
|
|
|
|
Саратовский государственный технический университет имени Гагарина Ю.А.
ОПРЕДЕЛЕНИЕ ФАЗОВОГО СОСТОЯНИЯ
И КОНЦЕНТРАЦИИ КОМПОНЕНТОВ В СПЛАВАХ
Методические указания
к выполнению практической работы по курсу
«Электротехническое и конструкционное материаловедение»,
для студентов направления 13.03.02 «Электроэнергетика и электротехника»
Одобрено
редакционно-издательским советом
Саратовского государственного
технического университета
Саратов 2015
Цель работы: ознакомиться с диаграммами состояния реальных двойных систем и приобрести практические навыки изучения превращений, происходящих в сплавах.
Основные положения
Диаграммы состояния имеют большое практическое значение, так как позволяют качественно характеризовать многие физико-химические, механические и технологические свойства сплавов. '>го, в свою очередь, позволяет рационально подойти к выбору материалов для изготовления различных изделий.
Практически для всех пар компонентов (химических элементов) экспериментально построены диаграммы состояния сплавов.
Диаграммы состояния двойных сплавов строятся в координатах температура-концентрация компонентов. Линии, соединяющие точки аналогичных превращений в системе, разграничивают области существования равновесных фаз. Под фазой понимается совокупность однородных частей сплава, одинаковых по всем свойствам.
На диаграммах состояния указаны области жидких и твердых фаз, а также двухфазные области. Твердые фазы могут быть чистыми компонентами, химическими соединениями компонентов или твердыми растворами на основе компонентов или химических соединений в зависимости от взаимоотношения сплавляемых компонентов.
|
|
|
На рис. I приведена диаграмма состояния двойных сплавов меди и никеля. Она состоит из двух линий. Верхняя линия диаграммы, выше которой сплавы находятся в жидком состоянии, называется линией ликвидус (жидкий). Эта линия - совокупность температурных точек начала кристаллизации сплавов.
Линия диаграммы, ниже которой сплавы находятся в твердом состоянии (закончился процесс кристаллизации) называется линией солидус (твердый). Но оси концентраций вправо увеличивается содержание Ni от 0 до 100%. Концентрация Сu, наоборот, увеличивается влево от 0 до 100%. Каждая точка на оси концентраций показывает полный химический состав сплава. Если, например, указано, что в сплаве содержится 30% Ni, значит остальное (до 100%) составляет Сu (такой сплав нанесен для примера на диаграмму).

Рис.I. Диаграмма состояния для случая неограниченной растворимости компонентов в твердом состоянии
I. Типы диаграмм состояний
Тип диаграммы состояния зависит от характера взаимодействия компонентов в сплавах данной системы и дает возможность предвидеть характер изменения структуры и свойств сплавов в равновесном, литом, деформированном и термически обработанном состояниях.
Можно выделить следующие основные типы диаграмм состояния (рис.2,вверху):
- с отсутствием растворимости в твердом состоянии (рис.2,а);
- с полной растворимостью в твердом состоянии (рис.2,6)
- с ограниченной растворимостью в твердом состоянии (рис.2,в);
- с образованием устойчивого химического соединения (рис.2, г)

Рис.2. Типы диаграмм состояния и свойства сплавов (внизу)
Методы анализа диаграмм
По диаграмме состояния для любого сплава при любой температуре можно определить фазовый состав, химический состав фаз, их количественное соотношение, изменения структуры при нагреве и охлаждении. Для этого используют правило отрезков и правило фаз.
|
|
|
Правило отрезков применяется в двухфазных областях и состоит из двух положений. Во-первых, как определить химический состав равновесных фаз и, во-вторых, как определить весовые количества этих фаз. Например, если мы рассматриваем сплав X в двухфазной области (рис.4) при температуре t| (точка х), то через точку х проводим горизонтальную линию до пересечения с линиями диаграммы, ограничивающими двухфазную область (в данном случае линию cd). Слева - область а- твердого раствора, справа - область жидкого раствора. Вот эти две фазы и находятся в равновесии в рассматриваемой двухфазной области.

Рис. 4. Диаграмма состояния с ограниченной растворимостью в
твердом состоянии
Проекции точек пересечения с и d на ось концентраций (С и Д) показывают химический состав сосуществующих фаз (α- твердого
раствора и жидкого раствора).
Если требуется определить весовое количество фазы в сплаве при заданной температуре, нужно разделить длину отрезка, противолежащего составу этой фазы, на общую длину отрезка. Так, весовое количество кристаллов твердого раствора в сплаве X (рис.4)в точке х равно

Правило фаз используют для анализа кривых охлаждения сплавов. Кривые охлаждения строят в координатах температура - время.
Для конденсированной системы (где нет паровой фазы) правило фаз можно записать так:
С = К- Ф + I
где К -число компонентов системы;
Ф -число фаз, находящихся в равновесии в данном сплаве при заданной температуре;
С -число степеней свободы, т.е. число независимых термодинамических параметров системы (температура и химический состав равновесных фаз-это и есть два параметра), при произвольном изменении которых в некотором интервале значений не исчезают старые и не проявляются новые фазы.
При С = 1 и С = 2 на кривой охлаждения наблюдается непрерывное понижение температуры с точками перегиба в критических температурных точках диаграммы. Например, в сплаве X (рис.4) при температуре t1° двухфазное состояние (Ж+α), поэтому имеется только одна степень свободы:
С1 = 2- 2 + I = I.
Это означает, что при охлаждении сплава в области температур между ликвидусом и солидусом температура его понижается, т. с. температура - независимая переменная. Но химический состав а -твердого раствора и.жидкого раствора не может изменяться произвольно. Для каждой температуры он устанавливается вполне определенный. Так, при температуре t1 состав жидкой фазы описывается точкой Д на оси концентраций, а при температуре Ц химический состав жидкого раствора описывается точкой Е, т.е. это будет уже жидкость эвтектического состава. При этой температуре на кривой охлаждения наблюдается горизонтальная площадка, т.к. температура сплава некоторое время (пока идет кристаллизация эвтектики) не изменяется, несмотря на то, что от сплава отбирается тепло. При этой температуре число степеней свободы Сэ = 0, т.к. в равновесии при эвтектическом превращении находятся три фазы (жидкая и две твердые). Когда вся жидкость затвердеет, останутся только две твердые фазы (а и В), появится одна степень свободы и температура будет понижаться ниже tэ (рис. 5).
|
|
|
На кривой охлаждения при температуре tα наблюдается точка перегиба, связанная, с кристаллизацией второй фазой - a - твердого раствора. В связи с выделением скрытой теплоты кристаллизации скорость охлаждения сплава уменьшается.

Рис.5. Кривая охлаждения сплава, X
Задания и методические указания
1. Предварительная подготовка.
а) Ознакомиться в разделе I с типами диаграмм состояний и видами превращений в сплавах.
б) Ознакомиться с методами анализа диаграмм состояния.
2. Решение задач но диаграммам состояния.
Каждый студент выполняет индивидуальное задание по указанию преподавателя.
При выполнении работы необходимо:
1. Начертить заданную диаграмму состояния и обозначить все линии диаграммы произвольными буквами.
2. Указать линии ликвидус и солидус.
3. Объяснить физический смысл линии вторичной кристаллизации (ниже линии солидус), если она есть.
4. Используя первое положение правила отрезков, указать равновесие фазы в двухфазных областях диаграммы (однофазные области обозначены).
5. Описать изотермическое превращение, изображаемое горизонтальной линией на диаграмме (если оно есть).
|
|
|
6. Описать превращения при кристаллизации жидкой фазы в сплавах 1 и 2, а если оно есть, то и вторичное превращение.
7. Описание фазовых превращений (п.6) иллюстрировать схематическими рисунками промежуточных микроструктур и конечной микроструктуры сплавов.
8. Построить кривые охлаждения сплавов в координатах температура-время, проверив правильность их построения с помощью правила фаз.
9. Определить химический состав фаз и их весовое количество (%) в заданных сплавах при заданных температурах.
Индивидуальные задания (см. Приложение)
| варианта | Концентрация второго компонента | Температура, " С | ||
| Сплав 1 | Сплав 2 | Сплав 1 | Сплав 2 | |
| МН) | ||||
| 11,6 | ||||
| 8,7 | ||||
Пример решения задачи
Дано: система сплавов Mg – Al2 Mg3
Сплав I - 7%А1, t1o,=200o С.
Сплав2~20%Аl, t2°=450°C
Решение
1.Вычерчиваем диаграмму состояния и обозначаем буквами все линии
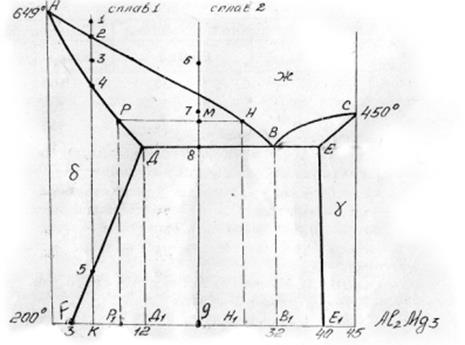
2. Линия ликвидус ABC, линия солидус АДЕС.
3. Линия вторичной кристаллизации ДF. Физический смысл этой линии состоит в том, что это линия насыщения. Она показывает предел растворимости А! в Mg при разных температурах от 436 до 200°С. С понижением температуры растворимость уменьшается с 12 до 3%.
4. В соответствии с правилом отрезков определяем, что в области АВД равновесные фазы δ - твердый раствор и жидкий раствор. В области ВСЕ жидкий раствор и γ - твердый раствор Mg в химическом соединении Al2Mg3. 14 двухфазной области ДРЕ|Е в равновесии находятся ft - твердый раствор и γ - твердый раствор.
5. Изотермическое превращение на диаграмме - это эвтектическое превращение (линия ДЕ). Оно заключается в том, что жидкий раствор концентрации В| (32% А1) затвердевает при постоянной температуре 436°С, образуя механическую смесь кристаллов 5 - твердого раствора (с концентрацией 12%А1) и кристаллов у - твердого раствора (с концентрацией 40%А1). Данная стадия кристаллизации может быть записана так:
436°
Жв→ δд + γe
6. Превращение при охлаждении сплава I.
|
|
|
Выше линии ликвидус в точке I в точке I сплав находится в жидком состоянии. Как только сплав охладится несколько ниже точки 2, из жидкого раствора начнут выделяться кристаллы δ - твердого раствора. Нa линии солидус в точке 4 кристаллизация жидкой фазы заканчивается. При температурах от точки 4 до точки 5 сплав однофазный, состоит только из зерен твердого раствора 5. При охлаждении сплава ниже точки 5 из 5 -твердого раствора выкристаллизовывается у - твердый раствор, уносящий из 5 - твердого раствора избыток AI. Если при температурах выше линии насыщения ДF (между точками 4 и 5) в 5 - твердом растворе содержалось 7% Al, то при температуре 200° в δ - твердом растворе остается только 3% Al (точка F).
Превращения при охлаждении сплава 2
Выше линии ликвидус АВ в точке 6 сплав находится в жидком состоянии. При охлаждении сплава несколько ниже точки 7 из жидкого раствора начнут выделяться кристаллы δ- твердого раствора. При этом состав жидкого раствора изменяется по мере понижения температуры от точки 7 до точки В (по линии ликвидус). Таким образом, жидкий раствор обедняется магнием (которого в δ - твердом растворе больше, чем в жидком растворе).
При температуре 436° (точка 8) этот жидкий раствор эвтектического состава (точка В) затвердевает, образуя эвтектику (см. п. 5). При дальнейшем охлаждении ниже 436° из δ - твердого раствора выкристаллизовывается у - твердый раствор в соответствии с линией насыщения ДF. При температуре 200° в δ - твердом растворе остается 3% Al
7. Схематичное изображение микроструктур сплавов в разных температурных точках.

8.Кривые охлаждения сплавов.

В сплаве I нигде нет трехфазного состояния, поэтому нет и температурной остановки на кривой охлаждения. Имеются только точки перегиба при температурах t2°, t3oи t4°>связанные с началом или окончанием кристаллизации второй фазы.
В сплаве 2 имеется точка перегиба на кривой охлаждения при температуре t70 в связи с началом кристаллизации из жидкого состояния. При температуре t8°=436° наблюдается равновесие трех фаз при эвтектической кристаллизации, число степеней свободы равно нулю и температура остается постоянной некоторое время, пока весь жидкий раствор не затвердеет. Тогда остаются в равновесии две твердые фазы (δ + γ) и температура сплава опять снижается.
9. Дляопределения химического состава фаз и их весового количества найдем заданные ло условию задачи точки па диаграмме, обозначим их буквами К и М. По правилу отрезков проводим через эти точки горизонтальные линии в пределах двухфазных областей. Получаем отрезки FEt сплава I и РН для сплава 2.
Для сплава I химический состав равновесных фаз определяется точками F(5 - твердый раствор) и ЕI (γ твердый раствор). В δ - твердом растворе 97% Mg и 3%А1. В γ -твердом растворе 60%Mg и 40%А1.
В сплаве 2 при 450°в равновесии находятся 5 - твердый раствор состава РI и жидкий раствор состава НI. В 5 - твердом растворе 90% Mg и 10%А1, в жидком растворе 72%Mg и 28%Аl.
В сплаве I количество γ- твердого раствора равно
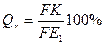 Qδ - (100- Qγ)%
Qδ - (100- Qγ)%
В сплаве 2 количество δ - твердого раствора равно
 Qж = (100-Qδ)%
Qж = (100-Qδ)%
Сопоставив длины укачанных отрезков, получим числепны<| значения весовых количеств фаз.
Литература
1 Гуляев А.П. Материаловедение. Учебник для вузов. 6-е изд. иерераб. и доп. М: Металлургия, 1986.С. 100-121, 139-140.
2. Геллер Ю.А., Рахштадт А.Г. Материаловедение. 4-е изд. М. Металлургия, 1975.С. 198-210.
Приложение
Диаграммы состояния двойных систем
(концентрации указаны в % но массе)






|
|
|


