 |
N – число перемещающихся электронов
|
|
|
|
Вопрос
Электродный потенциал металлических электродов 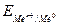
Разность электродных потенциалов в пределах двойного электрического слоя, возникшего на границе раздела Ме/р-р при достижении равновесия, называется равновесным электродным потенциалом металлического электрода: 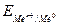 .
.
Знак соответствует знаку заряда пластины Ме.Чем активнее Ме, тем больше он ионов посылает
В раствор, тем более (—) заряд его пластины и более (—) значение его электродного потенциала Т.о. равновесный электродный потенциал металлического электрода – есть количественная ха-
рактеристика активности Ме в химических реак  циях в растворах.
циях в растворах.
- стандартный равновесный электродный потенциал.

 Формула НЕРНСТА
Формула НЕРНСТА
R – универсальная газовая Const (8,314 Дж/моль∙К),
Т – абсолютная температура, К,
F – число Фарадея (96500 кл/моль),
N – заряд иона металла в р-ре,
[Men+] – концентрация ионов металла в р-ре (аМеn+), моль/л
------------------------------------------------------------------------------------------------------------------------------------------
Вопрос
Общие химические свойства металлов
1. Взаимодействие с растворами солей
Чем активнее Ме и ниже значение его 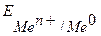 , тем легче его атомы окисляются в растворе, а ионы труднее восстанавливаются из раствора.
, тем легче его атомы окисляются в растворе, а ионы труднее восстанавливаются из раствора.
Поэтому более активный Ме вытесняет менее активный из растворов солей. Чем больше ∆Е между металлами,тем активнее реакция.
Взаимодействие с кислотами
А) кислота бескислородная (концентр. или разбавленная: HCl, H2S) и кислородсодержащая разбавленная: H2SO4. Ме, стоящие до водорода, вытесняют Н2 из кислоты, чем активнее Ме, тем интенсивнее реакция.
Б) Кислота кислородсодержащая концентрированная и HNO3 любой концентрации:
|
|
|
Реагируют Ме от Li до Hg, но Н2 из кислоты невытесняется, окислитель – атом неметалла кислотного остатка кислоты.
Взаимодействие с водой
По отношению к Н2О Ме делятся:
Активные; пассивирующие; инертные.
Активные (от Li до Na) взаимодействуют при t комнт., вытесняют Н2 и образуют щелочь.
Пассивирующие Ме реагируют с Н2О при нагревании, продукты реакции – нерастворимые оксиды и гидроксиды Ме, которые оседают на Ме и препятствуют дальнейшему протеканию процесса.
Инертные Ме вообще не реагируют с водой: от Ni до Au
Взаимодействие со щелочами
Со щелочами реагируют амфотерные Ме: Al, Zn, Be, Cr,Sn, Pb и др. Продукты реакций в растворах щелочей – комплексные соединения и газообразный Н2.
Взаимодействие с простыми окислителями:O2, F2, Cl2, S и др.
Реакцию идут с выделением тепла, интенсивность процессов зависит от активности Ме и окислителя.
Вопрос
Электрохимические реакции – процессы, в которых энергия ОВР превращается в электрическуюи наоборот.Полуреакции окисления и восстановления пространственно разделены и протекают на отдельных электродах
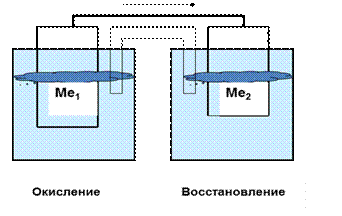
ТИПЫ ЭЛЕКТРОДОВ
Электроды I рода: обратимы относительно катиона Ме, металлическая пластина, опущенная в раствор соли этого металла.
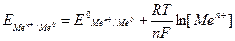
- расчёт электродного потенциала
Электроды II рода: (обратимы относительно аниона An cоли), Ме пластина, покрытая малорастворимым соединением этого Ме (соль, оксид), опущена в раствор электролита, содержащего анионы, одноименные с покрытием.
Газовые электроды: газообразное в-во подается на поверхность инертного Ме, в растворе имеются ионы, являющиеся продуктами окисления или восстановления газа.
Окислительно-восстановительные (редокси) электроды: инертный Ме (Pt) помещен в р-р электролита, содержащего как окисленную, так и восстановленную форму конкретного в-ва. Инертный Ме – проводник электронов.
|
|
|
Гальванический элемент «Якоби-Даниэля»
Zn – Cu
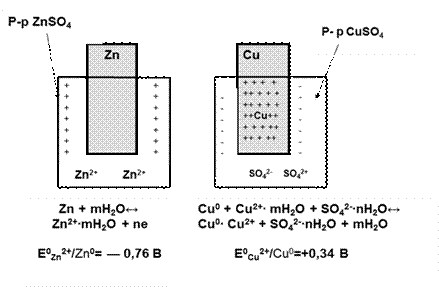
Соединим электроды внешним проводником:

Токообразующая реакция:
Zn0 + Cu2+ = Zn2+ +Cu0
Zn + CuSO4 = ZnSO4 + Cu

ЭДС гэ (электродвижущая сила) – это max разность электродных потенциалов, которая может быть получена при работе элемента, при условии, что ток в цепи отсутствует. ЭДС пропорциональна работе, совершаемой электронами в цепи и > 0.
ЭДС = ∆Е = ЕК – ЕА >0,[B
∆GГЭ = - nF∆E, [Дж]
n – число перемещающихся электронов
F – Const Фарадея (96500 Кл/моль)
Вопрос
Концентрационные г.э.


Вопрос
Аккумуляторы – г.э. многоразового действия, способные превращать накопленную химическую энергию в электрическую при разряде, и электрическую в химическую при заряде.
|
|
|


