 |
Мероприятия по охране труда и окружающей среды при выплавке стали 45г17ю3
|
|
|
|
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. ОБЩАЯ ЧАСТЬ
2. СПЕЦИАЛЬНАЯ ЧАСТЬ
3. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВА
4. ЭКОНОМИКА ПРОИЗВОДСТВА
5. МЕРОПРИЯТИЯ ПО ОХРАНЕ ТРУДА И ОКРУЖАЮЩЕЙ СРЕДЫ ПРИ ВЫПЛАВКЕ СТАЛИ 45Г17Ю3
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Электрометаллургия - отрасль техники, занимающаяся восстановлением металлов из их окислов и получении стали и сплавов различного состава с использованием электрической энергии как источника тепла. Электрическая печь имеет ряд существенных преимуществ перед другими сталеплавильными агрегатами, поэтому высоколегированные инструментальные стали, нержавеющие, жаростойкие и жаропрочные, а также многие конструкционные стали выплавляют только в эликртрических печах.
В электропечи можно получать сталь с низким содержанием серы и фосфора, можно полнее расскислить металл, обеспечить низкое содержание в стали не металлических включений. В электропечи значительно меньше потери легирующих элементов, вводимых в виде ферросплавов, значительно выше использование ценных составляющих, вносимых отходами легированных сталей.
В электропечах легко осуществить быстрый подъем и точное регулирование температуры металлической ванны в узких пределах. В ней можно проводить все металлургические процессы, создавая окислительную, восстановительную или нейтральную атмосферу, можно выплавлять сталь любого состава.
Расчеты показывают, что себестоимость легированной стали, выплавленной в ДСП-l00 [см. приложение 5, 6], ниже, чем себестоимость той же стали, выплавленной в 100 т. мартеновских печах, себестоимость углеродистой и малолегированной стали может быть даже значительно ниже мартеновской. Выплавка сталей мартеновского сортамента, в мощных дуговых печах более выгодна, чем выплавленная в мартеновских печах.
|
|
|
Большое распространение среди высокомарганцевых сталей получила сталь 45Г17ЮЗ. Данную марку стали я, предлагая выплавлять на заводе АО «БЦЛ». Она используется для изготовления литых деталей, работающих в условиях абразивного изнашивания в сочетании с ударными нагрузками и большими удельными давлениями.
Сталь 45Г17ЮЗ имеет следующий состав: 0.40-0.50%С; не более 0.60%Si; 16.0-18.0%Мn; не более 0,030%S; не более 0.040%Р; не более 0.50%Cr; не более 0.50%Ni; 2.40-З.60%Аl.
Из этой стали получают отливки, прокат (рельсы, плиты, листы, прутки) и кузнечные заготовки. Основными потребителями этой стали являются сельскохозяйственное и транспортное машиностроение, заводы горнорудного и обогатительного оборудования, металлургическая и оборонная промышленность. Из стали 45Г17ЮЗ получают в литом или горячедеформированном виде: трубы для магистральных трубопроводов, немагнитные бандажные кольца для электродвигателей.
Относительно высокая хладостойкость отливок позволяет использовать их при весьма низких температурах (-50 С), что имеет важное значение в связи с развитием промышленности и строительства.
ОБЩАЯ ЧАСТЬ
1.1. Обоснование проекта
Основной причиной целесообразности производства стали 45Г17ЮЗ является повышенный спрос на высококачественные детали из износостойких сталей, одной из которых является 45Г17ЮЗ.
Второй причиной является относительная дешевизна легирующих элементов марганца и алюминия.
1.2. Технология выплавки стали в дуговых печах.
На металлургических предприятиях сталь в дуговых печах выплавляется следующими методами:
- с полным расплавлением из свежей углеродистой шихты;
- переплавом легированных отходов без окисления или сплавлением чистых материалов;
- переплавом легированных отходов с окислением кислорода;
|
|
|
- смешиванием металла из нескольких печей в одном ковше.
При выплавке стали последним методом, металл из нескольких печей смешивают в одном ковше. При использовании двух печей в одной из них плавка ведётся методом переплава легированных отходов, а в другой с полным окислением.
Независимо от метода выплавки металл может подвергаться внепечной обработке - вакуумированию, продувке нейтральными газами, обработке синтетическими шлаками. Выплавка стали может производится одно - или двушлаковым процессом.
При выборе процесса учитывают качество шихтовых материалов и требования, предъявляемые к готовой стали. Все материалы - металлическая шихта, шлакообразующие и ферросплавы - должны соответствовать требованиям действующих ГОСТов и ТУ. Известь. Разрешается применять только свежеобработанную. Технологический процесс получения стали в дуговых печах по первому методу состоит из ряда взаимосвязанных и дополняющих друг друга этапов - подготовки шихтовых материалов и плавке, заливки шихты, периодов плавления, окислительного и восстановительного периодов и выпуска стали из печи.
После заправки дуговой печи, удалению остатков металла и шлака предыдущей плавки разгружают шихту, состоящую из железостального лома (до 90%), предельного чугуна (до 10%), электродного боя и 2-3% извести и железной руды.
Шихту составляют из расчета получения по расплавлении ванны металла с содержанием углерода на 0,35-0,40% выше верхнего предела, предусмотренного ГОСТом ТУ для стали данной марки.
В окислительный период электроплавки решаются следующие технологические задачи: снижение содержания фосфора в металле до 0,002% и ниже, возможно полное удаление растворенных в металле газов (азота и водорода) и неметаллических включений нагрев металла до заданной температуры плавления стали. Момент присадки окислителей или начало продувки кислородом при установленной температуре считается началом окислительного периода. В окислительный период происходит окисление углерода, кремния, марганца, фосфора и др. элементов. Образующиеся оксиды SiO2, МпО, Р205 переводит в шлак. Для ускорения окислительных процессов в электропечах присаживается железная руда или подается газообразный кислород.
|
|
|
Продувку ванны кислородом осуществляют с помощью кислородных труб или водо-охлаждаемых кислородных фурм, автоматически управляемых с пульта управления, скорость окисления углерода при продувке ванны кислородом возрастает в 3-5 раз. Разнообразный кислород целесообразно подавать под давлением 10,5-1,2 МПа, что обеспечивает его глубокое проникновение в металл и получение развития поверхности.
Энергичное равное кипение ванны в окислительный период обеспечивается тогда, когда железная руда вводится в достаточно нагретую ванну. При низкой температуре металла и небольшом содержании металла и небольшом содержании углерода кипение протекает всяко.
К концу окислительного периода, химический состав шлака находится в следующих пределах %; СаО 35 - 50; Si02 10 -20; МпО 4 -12; MgO 4 -15; Аl2Оз 3 -7; FeO 12 - 30; Р205 0,4 -1,5. нижний предел содержания FeO в шлаке характерен для плавок среднеуглеродистых сталей, верхний предел относится к плавкам низкоуглеродистой стали(0,06 - 0,08% С).
Ускорение резино-химических процессов в окислительный период можно получать путём вдувания материалов в порошкообразном виде. Получила распространение смеси порошкообразных материалов, содержащая 75% извести, 13% окалина, 10% плавленого шпата.
Процесс рафинирования металла восстановительного периода. После расплавления шихты из печи самотеком сливается максимальное количество шлака и начинается продувка ванны кислородом, подаваемым через сводовую фурму. Если содержание фосфора в металле перед продувкой кислородом повышенное, в печь загружают известь и плавиковый шпат. Продувку ведут до заданного содержания углерода в металле. После прекращения продувки в печь вводят силикомарганец и ферромарганец, которые обеспечивают получение необходимого количества марганца и хрома. Затем сталь выпускают в ковш, куда для получения требуемого содержания кремния и раскисления вводят ферросилиций и алюминий. Восстановительный период является наиболее важным и последним периодом плавки, во время которого необходимо: расскислить металл и удалить как можно большее количество кислорода; осуществить достаточно глубокую десульфурацию металлической ванны, довести химический состав металла до требуемого состава готовой стали.
|
|
|
Началом восстановительного периода считается момент начала науглероживания или присадки раскислителей, а при отсутствии этих операций - начало присадки шлакообразующих. Помешать концентрацию кислорода в металле в восстановительный период плавки можно двумя путями - раскислением шлака или раскислением самого металла. Раскисление шлака (так называется диффузионное) основано на законе распределения кислорода между шламом и металлом. Для диффузионного раскисления стали применяют кокс или электродный бой. При определенных условиях, могут применяться порошки ферросилиция, алюминия и других раскислителей. В зоне дуг протекает химическая реакция образования карбида кальция:
(СаО) + 3Ств=(СаС2) + {СО}
который взаимодействует с FeO шлака по реакции:
(СаС2)+ 3 (FeO) =3[Fe] + 2 {СО} + (СаО)
образующийся под электродами карбид кальция диффузирует по всему объему шлака. В зависимости от содержания карбида кальция конечные шлаки восстановительного периода разделяются на белые и карбидные шлаки, содержащие <2% СаС2 относятся к белым шлакам, а >2% -карбидным. Ниже приводятся примерные составы белого и карбидного шлаков.
СаО 52-62; Si02 10-20; FeO до 0,8; МпО 6-10;
Аl2Оз 1,5-3,0; CaF2 5-10; СаС2 до 1,5;
карбидного (масс %)- СаО 55-65;
Si02 10-15; FeO до 0,5; МпО до 0,3;
Mg0 6-10; Аl2Оз 2-3; CaF2 8-12; СаС2 2-4.
Белые и карбидные шлаки наводят следующим образом, после смачивания окислительного шлака на зеркала металла загружают шлаковую смесь, состоящую из извести и плавикового шпата, как только смесь расплавится и образовавшийся шлак покроет всю поверхность ванны, на него задают в соответствующих количествах известь, плавиковый шпат и молотый коксик. для получения карбидного шлака количество коксика в смеси увеличивается. При просветлении шлака, связанном с уменьшением содержания FeO в нем, в смесь добавляют 45 или 75%-ный ферросилиций. Карбидный шлак вязкий и плохо отделяется от его науглероживающие действия на металл: 3 (FeO) + (СаО2) =3[Fe] + (СаО) + 2 {СО}.
При раскислении металла под карбидным шлаком из кремнезема шлака восстанавливается кремний: 3 (Si02)+ 2 (СаС2) =3[Si] + 2/Са+4{СО}.
Согласно реакции
3(Si02)+2(CaC2)=3[Si]+2(Ca)+4{CO} содержание кремния в металле может увеличиваться до 0,10%
Поверхностно активными компонентами белого и карбидного шлаков являются СаС2 и CaF2, а неактивными СаО и АI2Оз. Практические данные подтверждают эти положения с увеличением концентрации СаС2 и CaF2 в карбидном шлаке сильнее смачивающем металл, загрязненность стали неметаллическими включениями заметна возрастает. При работе на белых шлаках чистота стали по экзонным включениям существенно увеличивается. Плохо также отделяется от металла шлак с высоким содержанием CaF2, поэтому плавиковый шпат часто заменяют боем шамота.
|
|
|
Особенности технологии выплавки стали методом переплава состоит в следующем. На металлургических предприятиях отходы легированной литой стали, могут достигать 25-30% с накоплением этих отходов близких по химическому составу сталей. Необходимое количество остальных элементов в шихте определяется с учетом состава выплавленной стали и того, что в период плавления они выгорают в следующих количествах %: Al-I00; Ti 80-90; Si 40-60; V-15-25; Мп 15-25; Cr 10-15.
1.3. Расчёты шихты для выплавки электростали. Расчёты шихты для выплавки в дуговой печи.
С основной футеровкой стали марки 45Г17Ю3 (с применениемкислорода) и тепловой баланс плавки.
Основное требование к шарикоподшипниковой стали низкое содержание неметаллических включений (оксидных и сульфидных)
Таблица 1
Химический состав шихтовых материалов, %
| Наименование | С | Si | Mn | Cr | AI | Р | S | Зола | Fe | Летучие |
| компонентов | ||||||||||
| Углеродистый лом | 0,67 | 0,20 | 0,32 | - | - | 0,038 | 0,041 | - | Ост | - |
| Ферромарганец | 6,0 | 2,0 | 72,0 | - | - | 0,30 | 0,03 | - | - | - |
| Электродный бой | 99,0 | - | - | - | - | - | - | 1,0 | - | - |
| Ферросилиций 75% | 0,12 | 72,0 | 0,4 | - | 2,5 | 0,04 | 0,03 | - | Ост | - |
| Феррохром | 4,0 | 2,0 | 0,4 | 70,0 | - | 0,05 | 0,03 | - | - | - |
| Алюминий | - | - | - | - | - | - | - | 2,0 | - | |
| Силикомарганец | 1,0 | 18,0 | 67,0 | - | - | 0,08 | 0,05 | - | Ост. | - |
Таблица 2
Состав шлакообразующих материалов, %
| Наименование | СаО | MgO | SiO2 | Аl2Oз | Fе2Oз | CaF2 | Р2O5 | СО2 | Н2O | S | Сr2O3 |
| Известь свежеобожонная | 2,0 | 3,3 | 2,5 | 1,0 | 0,60 | - | 0,10 | 0,2 | 0,2 | 0,1 | - |
| Железная руда | 0,10 | 0,3 | 6,25 | 2,5 | 90,0 | - | 0,15 | - | 0,7 | - | - |
| Плавиковый шпат | 0,40 | - | 3,1 | 0,2 | 0,8 | 95,0 | - | 0,3 | - | 0,2 | - |
| Магнезито-хромит | 2,0 | 66,0 | 6,5 | 4,0 | 11,5 | - | - | - | - | - | 10,0 |
| Магнезит | 3,50 | 90,25 | 3,45 | 0,80 | 2,0 | - | - | - | - | - | - |
| Зола электродов | 11,8 | - | 56,5 | 31,7 | - | - | - | - | - | - | - |
| Шамот | 0,7 | 0,3 | 62,0 | 35,0 | 2,0 | - | - | - | - | - | - |
Таблица 3
Шихтовые материалы вносят, кг
| Наименование | Вес, кг | С | Si | Mn | P | S |
| Лом углеродистый | 0,07 | 0,20 | 0,32 | 0,038 | 0,041 |
Период плавления шихты.
Во время плавления в печь загружают 2,5% (от веса садки) извести, 0,5% шамотного боя и 1 % железной руды.
Во время плавления окисляются 20% остается углерода в металле Кремний. Угар кремния составляет 70%. Перейдет кремния в шлак 0,20*0,70=0,14 кг.; останется кремния в металле 0,20-0,14=0,06 кг.
Марганец. Угар марганца равен 50%. Перейдет марганца в шлак: 0,32*0,5=0,16 кг.
Фосфор. Угар фосфора составит 60%. Перейдет фосфора в шлак: 0,038*0,6=0,0228 кг.;
останется в металле:
0,038-0,0228=0,0152 кг.
Сера. Можно принять, что сера, содержащаяся в металле, во время плавления не выгорает; сера, вносимая коксом улетучивается.
Железо. Угар железа составит 2,0%. Перейдет в шлак и улетучивается в зоне электрических дуг 98,731 *0,02=1,974 кг.;
останется в ванне 98,731-1,974=96,757 кг.
Расчет кислорода, необходимого для окисления смесей металла в период плавления. Содержание закиси железа, растворенной в металле, определяют по приближенной формуле Феттерса и Чипмана:
[%С] * [%FeO]=O,O 124+0,05 [%С].
Таблиц 4.
Количество кислорода, необходимого для окисления примесей.
| Элемент | Окисляется, кг. |
| Углерод | 0,134 |
| Кремний | 0,08 |
| Марганец | 0,16 |
| Фосфор | 0,0152 |
| Железо | 1,974 |
| Железо | 1,974 |
| Всего: | 4,3372 |
В металле, содержащем 1,2% С содержание растворенной закиси железа составит 0,06%.
Так как данные по формуле Феттерса завышены, то принимаем содержание кислорода в металле: 0,0018%. 0,0018*4,5=0,0072% FeO, т.е. приближенно 96*0,0072: 1 00=0,069 кг. FeO, для того потребуется: кислорода 0,0069* 16:72=0,0015 кг, железа 0,0069-0,0015=0,0054 кг. Общая потребность в кислороде 1,974+0,0015=1,9755 кг.
Во введенной железной руде содержится 0,90 кг Fе2О3или 0,27 кг кислорода и 0,63 кг железа.
2. Необходимо внести в металл, газообразного кислорода:
1,975-0,27=1,705.
3. Количество железа к моменту растворения составит:
98,731-1,974-0,0054+0,63=97,3 кг.
Состав металла в первой пробе по расплавлении: кг %
Кг %
С-О,536 0,545
Si-0,06 0,06
Мп-0,16 0,16
S-0,041 0,041
Р-0,0152 0,015
FeO-0,0089 0,007
Fe-97,382 99,172
98,201 100,00
Шлак периода плавления.
Поступает в шлак из металла, кг:
Si02 0,06*60:28=0,128
МnO 0,0152*142:62=0,034
Р2O5 0,0152* 142:62=0,034
FeO 1,974*0,12*72:56=0,304
Fе2O3 1,974*0,03* 160: 112=0,084
Поступает в шлак с известью (кол-во извести 2,5 кг) кг:
CaO (2,5*92,0)/100=2,300
MnO (2,5*3,3)/100=0,082
SiO2 (2,5*2,5)/100=0,063
AL2O3 (2,5*1,0)/100=0,025
Fe2O3 (2,5*0,60)/100=0,015
P2O5 (2,5*0,1)/100=0,003
Поступает в шлак с рудой (количество железной руды 1 кг) кг:
CaO (1,0*0,10)/100=0,001
Mg (1,0*0,3)/100=0,003
SiO2 (1,0*6,25)/100=0,063
Al2O3 (1,0*2,5)/100=0,025
P2O5 (1,0*0,15)/100=0,002
Fe2O3 (1,0*90,0)100=0,900 (Fe2O3 руда расходуется на окисление примесей).
Окислительный период плавки.
Углерод (97*0,10)/100=0,097 кг к концу окислительного периода в металле
должно быть углерода приблизительно: 0,097 кг; выгорит 0,536 – 0,097 = 0,439
Марганец. К концу периода останется в металле приблизительно 0,12% Mn или (97*0,16)/100=0,156 кг;
Окислится 0,148-0,155=0,007 кг.
Кремний. При продувке кислородом практически окислится весь кремний, т.е. окислится 041 кг.
Фосфор. Считаем, что к концу окислительного периода в металле останется 0,015% P, или (97*0,015)/100=0,014 кг. окислится 0,015-0,010=0,005 кг.
Сера. Из металла удалено 0,01 кг. серы останется в металле 0,02 кг. серы.
Таблица 5.
Количество FeO, необходимое для окисления примесей.
| Элемент | Окисляется | Химическое уравнение | Расход на единицу элементов | Требуется закиси железа, кг |
| Углерод | 0,439 | FeO+C-Fe+CO | 72/12=6 | 0,439*6=2,634 |
| Марганец | 0,007 | FeO+Mn=Fe+MnO | 72/55=1,3 | 0,007*1,3=0,009 |
| Кремний | 0,041 | 2Fe+Si=2Fe+SiO2 | 144/28=5,1 | 0,041*5,1=0,209 |
| Фосфор | 5FeO+2P=5Fe+P2O5 | 360/62=5,8 | 0,015*5,8=0,017 | |
| Итого: | 0,501 | 2,933 |
Для образования 3,188 кг FeO требуется:
Кислорода (2,933*16/72=0,0651)
Железа (2,933-0,0651=2,282)
0,9-0,007=0,083
97*0,0083/100=0,080
Кислород (0,080*16/72=0,017)
Железа (0,080-0,017=0,063)
Количество FeO, потребное для поддержания в шлаке определенной концентрации этого окисла.
Для металла с 0,10 С примем содержание Feобщ в шлаке равным 12%.
Для распределения железа между FeO и Fe2O3 можно задаться отношением 
Примем 

X=3Y
X=9
3Y+Y=12

Вес шлака окислительного периода.
Подлежит удалению 0,015% р. Для удаления фосфора при нарастающей температуре металла требуется основность шлака 2,5-3,0 и обновление его. Учитывая это обстоятельство, принимаем среднее содержание пяти окиси фосфора во вновь наводимом шлаке, равным 0,5%.
Отсюда вес вновь наводимого шлака (без учета остатков шлака периода плавления):

Принимаем, что шлак окислительного периода удален на 70%.
Остается шлака в печи 4,538*0,3=1,361 кг.
Общий вес шлака окислительного периода.
6,8+1,36=8,16
Закись марганца вносится шлаком периода плавления: 0,206*0,3=0,061
Окисляющемся марганцем из металла: 0,007*71/55=0,009
Всего вносится: 0,061+0,009=0,07 кг MnO
Окись магния вноситься:
Шлаком периода плавления 0,694*0,3=0,208
Сводом 0,07*0,66=0,046 кг
Подиной и стенками 0,45*0,9025=0,406
Если обозначить известь через X, то известь внесет X*0.033 кг MgO
Окись кальция вносится:
Шлаком периода плавления 2,328*0,3=0,698 кг

Известью 0,92 x
Всего вносится кальция 0,714+0,92 x =1,634
Сумма MnO+MgO+CaO=8,16*0,65=5,30 кг или 0,07+0,693+0,033+0,714+0,92=2,43 кг 0,953 x =0,95
Итак, потребуется извести: x =0,99
Потребность в шамотном бое.
Определяем по содержанию кремнезема.
Кремнезем вносится:
Шлаком периода плавления 0,591*0,3=0,177
Окисляющимся кремнием из металла 0,041*60/28=0,087
Сводом 0,07*0,065=0,004
Подиной и стенками 0,45*0,0345=0,015
Известью 0,99*0,025=0,024
Всего вноситься 0,307 кг SiO2
Требуется кремнезема для получения основности:
(0,714+0,92*0,99)/0,62-0,377
Поступление в шлак железа.
Из шлака периода плавления:
0,304*0,3-0,09 кг FeO
0,132*0,3=0,039 кг Fe2O3
Из свода:
0,07*0,115=0,008 кг Fe2O3
Из подины и стенок:
0,45*0,02=0,009 кг Fe2O3
Вносится известью:
0,99*0,006=0,005 кг Fe2O3
Итого вносится 0,09 кг FeO и 0,088 кг Fe2O3
По приведенному выше по расчету шлак должен содержаться:
11,5% или 6,8%*0,115=0,782 кг FeO 4,28 или 6,8*0,042=0,285 кг Fe2O3
Для повышения окисленности шлака требуется:
Железа 
Кислорода 0,691-0,538=0,153 кг

Кислорода 0,623-0,436=0,187
Источники поступление [см. приложение1].
Таблица 7.
Выход из состава металла к концу окислительного периода.
| Элемент | Кг | % |
| Углерод | 0,097 | 0,1 |
| Кремний | 0,00 | 0,00 |
| Марганец | 0,155 | 0,16 |
| Фосфор | 0,014 | 0,014 |
| Сера | 0,020 | 0,021 |
| Закись | 
| 0,094 |
| Железо | 97,382 | - |
При окислении элементов 
Расходуется на образование закиси и окиси железа:
2,282+0,063+0,538+0,436=3,319
| Всего железа | 96,344 | 96,611 |
| Всего стали | 96,72 |
Количество газов I периода (плавления и окисления)
При окислении углерода металла образуется окись углерода в количестве:
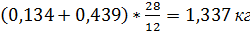 в течении I периода расходуется графитированных электродов на 100 кг шихты:
в течении I периода расходуется графитированных электродов на 100 кг шихты:
0,42+0,14=0,56 кг или 0,56*0,99-0,554 кг углерода.
С образованием окиси углерода сгорает: 0,554*0,7=0,388 кг углерода и образуется:  на что потребуется: 0905-0,388=0,517 кг O.
на что потребуется: 0905-0,388=0,517 кг O.
С образование углекислого газа сгорает: 0,554*0,30=0,166 кг O, и образуется: 0,166*44/12=0,609 кг CO2, на что потребуется: 0,609-0,166=0,433 кг O.
Мы рассчитали, что для периодов плавления и окисления потребуется кислорода:
1,107+0,651+0,017+0,153+0,187=2,115, всего потребуется кислорода: 2,115+0,443+0,517=3,075. Причем, что 50% кислорода поступит с воздухом, потребуется газообразного кислорода: 3,075*0,5=1,538.
Считаю использование O равным 85, находим, что в плавление и окислительный период необходимо подать газообразного кислорода: 1,538/0,85=1,089 кг или технического кислорода (98% O2)
1,809/0,98=1,846 кг или 1,846*22,4/32=1292 м3
С кислородом вносится азота около 29%, т.е. 1,846-1,809=0,037 кг.
Для окислительных процессов используется кислорода воздуха: 3,075*0,5-1,538 кг или 1,538 кг или 1,538*22,4/32=1,077 м3, кислороду сопутствует азот (включая аргон и прочие газы): 1,538*77/23=5,149 кг или 1,077*79/21=4,051 м3.
Объем воздуха составит: 1,077+4,051=5,128.
Вес воздуха составит: 1,538+5,149=6,687 кг.
При нагреве извести выделяются, кг:
CO2(2,5+0,99)*0,002=0,007
H2O(2,5+0,99)*0,002=0,007
При нагреве руды выделяются H2O:
1*0,007=0,007 кг влага вносимая воздухом.
Допусти, что температура воздуха  , давление – 760 мм, относительная влажность 70%. По таблицам находим, что упругость насыщенного водяного пара при
, давление – 760 мм, относительная влажность 70%. По таблицам находим, что упругость насыщенного водяного пара при  равна 17,5 мм ртутного столба. Упругость водяных паров в воздухе (сгорает) составит: 17,5*0,7=12,25 мм. Количество влажного атмосферного воздуха при температуре
равна 17,5 мм ртутного столба. Упругость водяных паров в воздухе (сгорает) составит: 17,5*0,7=12,25 мм. Количество влажного атмосферного воздуха при температуре  и давлении 760 мм будет равно:
и давлении 760 мм будет равно: 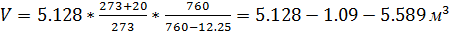 .
.
Точка роста t, при p=12,25 мм, лежит около  .
.
Вес водяного пара в 1м3 атмосферного воздуха.

Воздух внесет с собой влаги: 0,0120*5,589=0,067
Всего влаги 0,007+0,007+0,007=0,081 кг.
Водяной пар будет восстановлен окисью углерода по реакции H2O+CO2+H2CO2. При этом образуется водорода: 0,081*2/18=0,009 кг.
Потребуется окиси углерода: 0,081*28/18=0,126 кг.
Образуется углекислого газа: 0,126*44/28=0,198 кг.
В периоды плавления и окисления израсходовано газообразного кислорода 1,809 кг. Из этого количества ушло в атмосферу печи 15% или 1,809*0,15=0,271 кг.
Сводный кислород будет окислять окись углерода с образованием углекислого газа по реакции CO+1/2O2=CO2
Образуется СO2= 0,271*44/16=0,745 кг.
Для этого потребуется CO: 0,745-0,271-0,474 кг.
Сводная таблица газов I периода.
| Элемент | Формула | Кг | % |
| Окись углерода | (1,337+0,905-0,126-0,474) | 1,642 | 19,55 |
| Углекислый газ | (0,009+0,007+0,0198+0,0745) | 1,559 | 18,57 |
| Водород | 0,009 | 0,11 | |
| Азот | (5,149+0,37) | 5,186 | 61,77 |
| Всего: | 8,396 |
Материальный баланс I-го периода.
| Израсходовано, кг | Получено, кг | ||
| Железного лома | Металла | 96,72 | |
| Железная руда | Шлака | (4,338*0,7+4,669)=7,846 | |
| Извести | 2,5+0,99=3,49 | Газов | 8,396 |
| Электродов | 0,56 | Улет железа | 
|
| Магнезита | 1,05 | Невязка | 0,338 (0,3%) |
| Шамотного боя | 0,882 | ||
| Воздух (влажного) | 0,0120+6,687=6,699 | ||
| Газообразного кислорода | 1,846 | ||
| Всего: | 115,697 |
Восстановительный период плавки.
Определение количества шлака. Количество шлака определяем исходя из задачи десульфурации. Задаемся целью удалить из металла такое количество серы, чтобы остаток ее не превышал 0,008%. В конце окислительного периода металл содержал 0,021-0,008=0,013% S. Подлежит удалению 0,021-0,008=0,013% S; 0,013*0,8/100=0,013 кг.
Для промышленной электропечи можно принять коэффициент распределения серы между шлаком и металлом:

Шлак должен содержать серы:
(S)=n[S]=30*0,008=0,24%, отсюда количество шлака:
 .
.
Шлак восстановительного периода образуется:
1. Из остатка шлака окислительного периода; можно принять, что в печи остается 5% шлака, т.е. 4,669*0,05=0,233 кг;
2. Из свода поступит: 0,03;
3. Из пода и стен: 0,45 кг;
4. Из извести, плавикового шпата, шамота и песка:
5,4-(0,233+0,09+0,45)=5,4-0,713=4,687 кг.
На основании практических данных принимаем, что в шлаковой смеси содержится:
Извести – 65% или 4,687*0,65=9,046;
Шпата – 13% или 4,687*0,13=0,609;
Шамота – 13% или 4,687*0,13=0,609;
Кокса 0,250 кг.
Расчет металлургических присадок.
Для предварительного осадочного периода раскисления требуется пускового 75% ферросилиция: 
Требуется алюминия: 10,8 кг/т
96,72*0,0008=0,007 кг потребуется феррохрома, содержащего 70% хрома
 , пусковой ферросилиций заданный в начале восстановительного периода внесет кремний 0,365*0,75*0,6=0,164 кг или
, пусковой ферросилиций заданный в начале восстановительного периода внесет кремний 0,365*0,75*0,6=0,164 кг или  в готовом металле должно быть 0,50% Si, к концу окислительного периода металл содержал кремний; необходимо добавить: 0,50-(0,17+0,014)=0,050-0,184-0,316%, требуется ферросилиция для введения недостающего количества кремния
в готовом металле должно быть 0,50% Si, к концу окислительного периода металл содержал кремний; необходимо добавить: 0,50-(0,17+0,014)=0,050-0,184-0,316%, требуется ферросилиция для введения недостающего количества кремния  .
.
При расчете добавки ферромарганца можно не учитывать угар, так как закись марганца, образовавшегося после присадки, впоследствии практически полностью восстанавливается при диффузионном раскислении шлака.
Для конечного раскисления применяют алюминий в количестве 0,5 кг/т в металл и столько же порошком на шлак.
Требуется алюминий в чушках.
 и 0,048 кг в порошке.
и 0,048 кг в порошке.
Предварительный состав и вес (кг) шлака восстановительного периода
[Приложение 2].
Окисляется Si из 75% FeSi 0,365*0,75*0,4=0,109, образуется SiO2 0,109*60/28=0,233, окисляется кремния 0,606*0,75*0,3= 0,136 кг, образуется SiO2 0,136*60/28=0,291.
Окисляется пускового Al0,077*0,98*0,90+0,048*0,98=0,60+0,048*0,98*1=0,068+0,028+0,047=0,143 кг, образуется Al2O3 0,143*102/54=0,270.
Раскисление. Раскисление металла идет в 3 стадии. В начале восстановительного периода проводят глубинное раскисление марганцем, кремнием, алюминием; позже диффузионное раскисление углеродом и кремнием, и наконец, перед выпуском – глубинное раскисление алюминием. Данные о роли отдельных раскислителей при таком методе раскисления отсутствуют. Равным образом нет данных о том, сколько кислорода, ранее поглощенного футеровкой ванны, переходит в металл и шлак, сколько кремния и алюминия окисляется кислородом воздуха. Так как 85-90% всего кислорода, облагораживаемого в готовом металле, связано с алюминием, примем, что весь марганец идет на легирование, кислород металла связывается с алюминием, 40% кислорода шлака восстанавливается углеродом и 60% - кремнием. Остальное количество углерода, кремния и алюминия окисляется кислородом воздуха. Кислорода в металле в конце окислительного периода содержится 0,906*16/72=0,021 кг.
Перед выпуском хорошо раскисленная сталь содержит 0,005 или 96,72*0,005/100=0,0048 кг кислорода. Для раскисления этого количества требуется алюминия: (0,021-0,0048)*54/48=0,018 кг; образуется глинозема 0,018*102/48=0,038 кг; восстановится железа 0,018*56/16=0,063 кг; и шлака восстановиться: 0,0035 кг Cr2O3; 0,041 P2O5 и 0,089 кг Fe2O3. В шлаке в конце окислительного периода останется 0,20% или 5,8*0,20/100=0,012 кг FeO т.е. восстановиться 0,039-0,012=0,024 кг FeO в результате реакции десульфурации CaO+FeS=CaS+FeO. Образуется закиси железа 0,013*78/32=0,029 кг.
Потребность в углероде 0,027 кг образуется окиси углерода 0,027/28/12=0,063 кг. Требуется 0,028 кг, образуется кремнезема 0,028*60/28=0,06 кг.
Расчет окончательного состава количества шлака восстановительного периода.
Около половины фтористого кальция реагирует с кремнеземом по реакции 2CaF2+SiO2=SiF4+2CaO фтористый кремний улетучивается для образования SiF4 требуется кремнезема 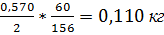 образуется
образуется  SiF4 и
SiF4 и  кг CaO.
кг CaO.
Таблица №9.
Восстановление окислов углеродом.
| Окисел | Вес, кг | Реакция | Расход углерода, кг | Переходит в металл при раскислении |
| FeO | (0,063+0,029)*0,4 =0,037 | FeO+C=Fe+CO | 0,037*72/72 =0,006 | 0,037*56/72 =0,029 |
| Fe2O3 | 0,089*0,4 =0,036 | Fe2O3+3C=2Fe+3CO | 0,036*36/160 =0,008 | 0,036*112/160 =0,025 |
Таблица №10.
Восстановление окислов кремнием.
| Окисел | Реакция | |||
| FeO | 0,092-0,037 =0,055 | 2FeO+Si=2Fe+SiO2 | 0,055*28/144*0,11 | 0,055*112/144 =0,043 |
| Fe2O3 | 0,089-0,036 =0,053 | 2 Fe2O3+2Si=4Fe+3SiO2 | 0,053*(3*28)/(2*160) =0,014 | 0,053*224/320 =0,037 |
| Cr2O3 | 0,004 | 2 Cr2O3+3Si=4Cr+3SiO2 | 0,004*(3*28)/(2*152) =0,001 | 0,004*(4*52)/(2*152) =0,003 |
| P2O5 | 0,004 | 2 P2O5+5Si=4P+5SiO2 | 0,004*(5*28)/(2*42) =0,002 | 0,004*(4*31)/(2*142) =0,002 |
Для реакции десульфурации требуется:
Окиси кальция 0,013*56/32=0,023 кг; железа 0,013*56/32=0,023 кг. Образуется сернистого кальция 0,013*72/32=0,029 кг. Чтобы связать серу из шлакообразующих по реакции CaO[S]C=CaS+CO. Требуется окиси кальция 0,013*12/32=0,005. Образуется сернистого кальция 0,013*72/32=0,029. Окиси углерода 0,023*28/56=0,011.
Вес (кг) металла к концу восстановительного периода [см. приложение 3], вес (кг) и состав шлака восстановительного периода [см. приложение 4].
Количество газов II периода.
В течении II периода на 100 кг металла расходуется графитированных электродов.
 или 0,14*0,99=0,138 кг углерода.
или 0,14*0,99=0,138 кг углерода.
Окисляется углерода кокса 0,250*0,8-0,02-0,014=0,166 кг принимаем, что углерод электродов и кокса окисляется кислородом воздуха до окиси углерода: углерода сгорает 0,138+0,166=0,304 кг, при этом образуется:  . Для горения требуется кислорода воздуха: 0,709-0,304=0,405 кг, до окисления 0,138-0,018=0,12 кг кремния, требуется кислорода воздуха
. Для горения требуется кислорода воздуха: 0,709-0,304=0,405 кг, до окисления 0,138-0,018=0,12 кг кремния, требуется кислорода воздуха  для окисления 0,143 кг алюминия требуется кислорода воздуха
для окисления 0,143 кг алюминия требуется кислорода воздуха  всего требуется кислорода воздуха 0,405+0,137+0,127=0,669 кг или
всего требуется кислорода воздуха 0,405+0,137+0,127=0,669 кг или  м3 кислороду сопутствует азот в количестве:
м3 кислороду сопутствует азот в количестве:  или 0,468*79/21=1,760 м3, вес воздуха 0,669+2,239=2,908,
или 0,468*79/21=1,760 м3, вес воздуха 0,669+2,239=2,908,
объем сухого воздуха 0,468+1,760=2,228 м3 количество влаги, вносимой воздухом (когда вес водяного пара в 1м3 воздуха равен 10,012 кг) 2,428*0,012=0,006 кг.
Всего влаги 0,029+0,006=0,035 кг. Допустимый водяной пар будет восстановлен окисью углерода. При этом образуется водорода: 
Потребуется окиси углерода  образуется углекислого газа
образуется углекислого газа  при разложении извести выделяется углекислого газа 3,406*0,002=0,006 при нагреве плавикового шпата выделяется 0,609*0,003=0,002 кг CO2.
при разложении извести выделяется углекислого газа 3,406*0,002=0,006 при нагреве плавикового шпата выделяется 0,609*0,003=0,002 кг CO2.
При раскислении углеродом образуется 0,028 кг CO. При образовании сернистого кальция из серы в шлакообразующих образуется 0,009 кг CO.
Кокс выделяет летучих 0,250*0,05=0,013 кг.
Таблица 11
Сводная таблица газов II периода.
| кг | % | |
| Окись углерода (0,709+0,063+0,011-0,054) | 0,829 | 22,10 |
| Углекислый газ (0,085+0,002+0,006) | 0,093 | 2,85 |
| Водород | 0,004 | 0,12 |
| Азот | 2,239 | 68,52 |
| Фтористый кремний | 0,190 | 5,82 |
| Летучие кокса 0,250*0,05 | 0,013 | 0,40 |
| Всего: | 3,268 |
Таблица 12
Материальный баланс II периода.
| Израсходовано, кг | Сумма | Получено, кг | Сумма |
| Металла I периода | 96,72 | Металла | 99,56 |
| Извести | 3,046 | Шлака | 5,641 |
| Плавикового шпата | 0,609 | Газов | 3,268 |
| Кокса | 0,250 | Итого: | 108,109 |
| Феррохрома | 0,718 | ||
| Ферросилиция 75% | 0,524 | ||
| Алюминия | 0,114 | ||
| Электродов | 0,140 | ||
| Шлака I периода | 0,233 | ||
| Магнезитохромита | 0,030 | ||
| Магнезита из футеровки | 0,450 | ||
| Шамотного боя | 0,609 | ||
| Ферромарганца | 1,45 | ||
| Воздуха | 2,907 | ||
|
|
|


