 |
Устойчивость комплексных соединений. Константа нестойкости
|
|
|
|
В растворах комплексных соединений существует система динамических равновесий, т. е. комплексные соединения подвержены в значительной степени электролитической диссоциации. Ионы или молекулы, находящиеся во внешней сфере, связаны в комплексном соединении гораздо слабее, чем ионы или молекулы, находящиеся во внутренней сфере. Такая различная прочность связи обусловливает характер диссоциации комплексных соединений.
Диссоциация комплексных соединений протекает по стадиям. На первой стадии комплексное соединение диссоциирует как сильный электролит, т. е. практически полностью. Далее, комплексный ион диссоциирует как слабый электролит по ступеням, т. е. лиганды отделяются от комплексообразователя постепенно. Например, диссоциация комплексной соли [Ag(NH3)2]Cl протекает по следующим стадиям:
Первая стадия: [Ag(NH3)2]Cl -><- [Ag(NH3)2]+ + Cl-
Вторая стадия:1. Ag(NH3)2]+ -><-AgNH3+ + NH3
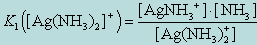
2. AgNH3+-><- Ag+ + NH3
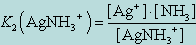
Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступеням. Так, в данном примере
 (9.1)
(9.1)
Чем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа называется константой нестойкости. Обратная величина константы нестойкости называется константой устойчивости:
 (9.2)
(9.2)
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса. Наиболее устойчивые в растворах комплексные ионы имеют наименьшие константы нестойкости. Так, среди соединений
[Ag(NO2)2] - [Ag(NH3)2] + [Ag(S2O3)] - [Ag(CN)2] -
|
|
|
K нест 1,3 · 10-3 5,8 · 10 -8 1,5 · 10 -9 1,4 · 10-20
устойчивость комплекса возрастает при переходе от [Ag(NO2)2] - к [Ag(CN)2] -.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости. Например, для иона [Ag(NH3)2] + Kнест = 5,8 · 10 -8, а для иона [Ag(CN)2] - Kнест = 1,4 · 10 -20, поэтому при действии раствора КСN аммиакат серебра разрушается с образованием иона [Ag(CN)2] -:
[Ag(NH3)2]Cl = 2KCN = K[Ag(CN)2] + 2NH3 = KCl
Зная константы нестойкости различных комплексов, можно теоретически вычислить концентрацию соответствующих простых ионов в растворах комплексных солей.
Пример 1.
Найти концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, если Kнест = 5,8 · 10 - 8.
Решение.
Обозначив искомую концентрацию Ag+ через х, из уравнения диссоциации комплекса
[Ag(NH3)2]+ находим
[NH3] = 2x; 
т. к. степень диссоциации комплекса незначительна. Следовательно, можно записать


От величины Kнест комплексного иона и KS осадка, который образует реактив с одним из продуктов распада комплекса, зависит, будут ли образовываться соответствующие осадки.
Пример 2.
Образуется ли осадок AgCl при прибавлении к 0,01М раствору [Ag(NH3)2]NO3 0,01М раствора KСl?
KS(AgCl) = 1,8 · 10 -10; Kнест[Ag(NH3)+2] = 5,8 10 -8.
Решение.
[ Ag+] = 5,25 ·10 -4 моль/л (см. пример 1), исходя из условия [Cl]- = 0,01 моль/л.
Для того чтобы выпал осадок AgCl, необходимо, чтобы
[ Ag+] · [Cl-]>KS(AgCl)
В данном примере
5,25 · 10 -4 · 10-2 = 5,25 · 10 -6 > 1,8 · 10 -10
Следовательно, осадок AgCl образуется.
При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант устойчивости образуемых ими комплексных соединений.
Например, катионы Ni2+, Co2+, Zn2+ дают устойчивые растворимые аммиакаты, а Al3+, Fe3+, Cr3+ менее склонны к комплексообразованию с аммиаком и осаждаются при действии аммиака в виде гидроксидов. Это позволяет разделить действием аммиака эти две группы катионов.
|
|
|
|
|
|


