 |
Билет 55.Понятие о пределах воспламенения и взрыва.3 предела взрыва.
|
|
|
|
Разветвленные цепные р-ции(ц.р.) могут переходить во взрывной режим при определ-ных давлениях,тем-ре,составе реакцион. смеси и др. переменных. Экспер-но, на примере окис-я сероводорода кислородом,было установлено,что смесь может 3 раза переходить во взрывной режим,т.е. в смеси можно создать 3 значения давлений и тем-ры,при к-рых она взрывается.Эти дав-я и тем-ры наз-ют пределами самовоспламенения смеси(см.рис.)  Это объяс-ся след. образом.При дав-ях ниже Р1 смесь H2S и O2 не взрыв-ся,т.к. она значит-но разбавлена(разрежена),и среднее число актов обрыва цепей на стенках сосуда, в к-ром нах-ся смесь, превышает число разветвлений цепей. Повышая,след-но,внешнюю поверх-ть сосуда или вводя в сосуд тв. зерна с развитой поверх-тью,можно изменять пределы дав-я и тем-ры для нижнего критич. предела взрыв-ти Р1.При Р1 смесь взрыв-ся,т.к. в этом случае число обрывов цепи уже ниже числа развития цепей.При дав-ях выше Р2 смесь не взрыв-ся,т.к. обрыв цепи происходит при столковении актив.частиц в объёме реакцион.смеси на пылинках(или др. массив.частицах).При дав-ях,равных Р2, смесь взрыв-ся,т.к. число разветвлений цепей выше числа их обрывов на третьих частицах.3-ий предел взрыв-ти происходит при Р3(повышение дав-я смеси) и обусловлен тепловой природой процессов,особ-но легко он проходит для экзотермич.р-ций.При сжатии смесей происходит их сильный разогрев,к-рый приводит к их взрыву.Тепловому взрыву способ-ют каталит.действи стенок сосуда,на к-рых при адсорбции могут создаваться актив.частицы.Особ-ть ц.р.- наличие периода индукции в превращении исх.смеси в-в.За время периода идукции в смеси накаплив-ся а.ч.,к-рые приводят к постепенному развитию ц.р. с послед. взрывом.
Это объяс-ся след. образом.При дав-ях ниже Р1 смесь H2S и O2 не взрыв-ся,т.к. она значит-но разбавлена(разрежена),и среднее число актов обрыва цепей на стенках сосуда, в к-ром нах-ся смесь, превышает число разветвлений цепей. Повышая,след-но,внешнюю поверх-ть сосуда или вводя в сосуд тв. зерна с развитой поверх-тью,можно изменять пределы дав-я и тем-ры для нижнего критич. предела взрыв-ти Р1.При Р1 смесь взрыв-ся,т.к. в этом случае число обрывов цепи уже ниже числа развития цепей.При дав-ях выше Р2 смесь не взрыв-ся,т.к. обрыв цепи происходит при столковении актив.частиц в объёме реакцион.смеси на пылинках(или др. массив.частицах).При дав-ях,равных Р2, смесь взрыв-ся,т.к. число разветвлений цепей выше числа их обрывов на третьих частицах.3-ий предел взрыв-ти происходит при Р3(повышение дав-я смеси) и обусловлен тепловой природой процессов,особ-но легко он проходит для экзотермич.р-ций.При сжатии смесей происходит их сильный разогрев,к-рый приводит к их взрыву.Тепловому взрыву способ-ют каталит.действи стенок сосуда,на к-рых при адсорбции могут создаваться актив.частицы.Особ-ть ц.р.- наличие периода индукции в превращении исх.смеси в-в.За время периода идукции в смеси накаплив-ся а.ч.,к-рые приводят к постепенному развитию ц.р. с послед. взрывом.  . P1,P2,Р-предел.дав-я взрыва и общ.внеш.дав.Т0-постоянная.При Р< P1 и P> P2 T0<0→затух-щий пр-с,при P1<Р< P2 T0>0→пр-с протекает с самоускорением.Т-хар-ет вр,в теч к-рого конц-я промеж. продуктов увел-ся в е раз. Вр,в теч. к-рого скорость пр-ся переходит от незначительной неизмер.вел. к оч.большой измер.величине.
. P1,P2,Р-предел.дав-я взрыва и общ.внеш.дав.Т0-постоянная.При Р< P1 и P> P2 T0<0→затух-щий пр-с,при P1<Р< P2 T0>0→пр-с протекает с самоускорением.Т-хар-ет вр,в теч к-рого конц-я промеж. продуктов увел-ся в е раз. Вр,в теч. к-рого скорость пр-ся переходит от незначительной неизмер.вел. к оч.большой измер.величине.
|
|
|
Билет56.Основные признаки катализа. Катализ – явление изменения скорости реакции в присутствии веществ – катализаторов, которые вступают в промежуточное взаимодействие с реагирующими веществами, но в процессе реакции не расходуются и в состав конечных продуктов не входят. К. участвует в образовании активированного комплекса. К. не может вызвать изменение энергии Гиббса, следовательно, не может вызвать протекание реакции. В состоянии равновесия К. в равной степени ускоряет прямую и обратную реакции.Специфичность катализа заключается в том, что реакции данного типа ускоряются К. лишь определенного химического состава. Так, кислотно-основные реакции ускоряются кислотами или основаниями, а ОВР – переходными металлами или их соединениями (особенно высоким каталитическим действием обладают элементы 8 группы). Специфичность обусловлена характером связей (ковалентная, донорно-акцепторная, водородная), которые возникают между катализатором и реагентом.
Билет57.Свойства катализатора. (К)К-в-во,к-рое,участвуя в элементар. стадиях хим.пр-са(х.р),изменяют скор-ть х.р.,и после завершения р-ции сами остаются хим-ки неизмен-ми.Физич. и текстурное состояние К может меняться.К,взаим-я с молекулами реагентов,обмен-ся с ними энергией и электронами.К могут снижать Еа и создавать благоприят. для взаим-я ориентацию мол-л.Элементар.акт может проходить т-ко м\у активир.м-ми.Роль К при возбуждении м-л реагентов сводится к изменению их орбитальной симметрии.К явл-ся в-во,если: 1) в-во должно влиять на изменение скор-ти х.р. при небольших его сод-ях в реакцион.смеси.Если в-во проявл-ет каталит.св-ва,то оно циклически участвует в элементар.стадиях превращ-я мол-л реагентов. 2) скор-ть х.р. меняется в завис-ти от конц К в реакцион.см. К участвует в образ-нии нестойких промежуточных соед-ний с м-ми реагентов. Ниж. предел каталитич. действия в-в зависит от природы и строения м-л реагир. в-в и К. Если К участвует в катализе с обр-ем промеж.комплекса(КС),то при равновес. сод-нии КС в смеси,скор. х.р. будет прямо пропорц-на конц.К.Если К участвует во взаим-вии с предварит-но возбужд. м-ми,то скор. х.р. может выражаться нулевым,дроб,положит,отриц порядком по конц К в завис-ти от его кол-ва в реакц.см. При нулевом порядке для конц. К происходит “выпадение” его из реакц.см. (скрытый катализ 1 рода).Если “выпадает” конц. одного из реагента и К,то возникает скрыт.катализ 2 рода.При отриц порядке по конц К скор-ть х.р. убывает и происходит самоотравление К или ингибирование К–ром нек-рых реагентов. 3) К,не смещая положения хим.равновесия в реакц.см.,способ-ет сокращению времени его достижения.Он одновременно влияет на скор-ть прям. и обрат. р-ций.К участвует т-ко в возбужд. м-л реаг. полем своих актив.центров и способ-ет снижению стерич.препятствий взим-вию возбуж.м-л. 4) Подверг-ся воздействию ядов и ингибиторов.Яды по дейсвию подразделяют: избирательные (выключ-ся отдел.ф-ции К);обратимые (происходит при умеренном связывании м-л яда актив.центрами);необратим(при прочном связывании);накапливающ-ся(при медлен накоплении яда на пов-ти К в ходе р-ции).Для описания закономер-тей отрав-я энергетич.однород. пов-тей тв.К:  ,А,А0-актив-ть отрав-го и исход.К;α-эмпирич.коэф-т;Г-кол-во яда.Для неоднород.пов-тей:
,А,А0-актив-ть отрав-го и исход.К;α-эмпирич.коэф-т;Г-кол-во яда.Для неоднород.пов-тей:  ; g-число м-л яда;z0-обл-ть миграции м-л яда на пов-ти К;β=gэф/g-вер-ть отравления актив.центра;gэф-число м-л яда,отрав-щих актив.ц.Отравляющее действие завис. от тем-ры,дав-я,природы и сп-ба приготовления К.Выше 973К отрав-е не происходит,т.к. яды разлаг-ся,а К полностью теряют актив-ть из-за структур. изменений. 5) Селективность- св-во К. ускорять р-цию лишь по одному из возможных путей.Селек-ть зависит от условий проведения и степени завершенности р-ции.
; g-число м-л яда;z0-обл-ть миграции м-л яда на пов-ти К;β=gэф/g-вер-ть отравления актив.центра;gэф-число м-л яда,отрав-щих актив.ц.Отравляющее действие завис. от тем-ры,дав-я,природы и сп-ба приготовления К.Выше 973К отрав-е не происходит,т.к. яды разлаг-ся,а К полностью теряют актив-ть из-за структур. изменений. 5) Селективность- св-во К. ускорять р-цию лишь по одному из возможных путей.Селек-ть зависит от условий проведения и степени завершенности р-ции.  ;xi-выход i-го цел.продукта,х-общ.превращ-е сырья. Чем выше селек-ть,тем меньше затрачивается энергии. 6) Промотирование и модифицирование К. В-ва,к-рые сами явл-ся каталитически актив.,но при добав-нии к-рых к К повыш-ся его актив-ть,наз. промоторами.Если при изменении добавок в-в в К актив-ть его вначале растёт,достигает макимума, а затем сниж-ся,то такие в-ва наз.модификаторами.
;xi-выход i-го цел.продукта,х-общ.превращ-е сырья. Чем выше селек-ть,тем меньше затрачивается энергии. 6) Промотирование и модифицирование К. В-ва,к-рые сами явл-ся каталитически актив.,но при добав-нии к-рых к К повыш-ся его актив-ть,наз. промоторами.Если при изменении добавок в-в в К актив-ть его вначале растёт,достигает макимума, а затем сниж-ся,то такие в-ва наз.модификаторами.  ;w0-скор х.р. без добав.;∆w0-прибав к скор за счёт добав,R-критерий модиф-я.R>w0-модиф.К, R<w0-отрав-е.Промоторы могут изменять струк-ру К,состояние каталит.центров, способствовать появл-ю модиф-ции с повыш.каталит. актив-тью.При повыш тем-рах или невыс.конц в кач-ве промотора примен-ют яды. 7) К не участвует в общ стехиомет-рии р-ции.
;w0-скор х.р. без добав.;∆w0-прибав к скор за счёт добав,R-критерий модиф-я.R>w0-модиф.К, R<w0-отрав-е.Промоторы могут изменять струк-ру К,состояние каталит.центров, способствовать появл-ю модиф-ции с повыш.каталит. актив-тью.При повыш тем-рах или невыс.конц в кач-ве промотора примен-ют яды. 7) К не участвует в общ стехиомет-рии р-ции.
|
|
|
|
|
|
Билет58.Общий и специфич. кислотно-основ.катализ. К кисл.-основ. кат-зу отн-ся пр-сы изомеризации,гидратации и дегидратации,гидолиза,этерификации и др. При бимол-ной гетерогенной катал-кой р-ции 1 из частиц явл-ся акцептором (электрофил), другая – донором (нуклеофил) пары электронов. Чем более ярко выражены св-ва электрофильности и нуклеофильности, тем выше скорость р-ции.В завис-ти от природы частиц, выступающих в качестве К., реакции кислотно-основного типа делятся на: 1. специфический кислотный катализ, включает реакции, катализируемые только ионами водорода (гидроксония). 2. специфический основный катализ, включает реакции, катализируемые ионами гидроксила. 3. общий кислотно-основной катализ, включает реакции, катализируемые любыми кислотами и основаниями Бренстеда. 4. электрофильно-нуклеофильный катализ, включает реакции, катализируемые акцепторами или донорами электронных пар.В общ случае скор. х.р.,проводимой в р-ре (вод. или невод) может повыш-ся под воздействием Н+,ОН-,Ме+,А-.МА(соль),к-ты,основания.Урав-е кинетики для р-ции  представ-ся:
представ-ся:  .Первый член отражает некатал-кое превращ-е в-ва.Для выявл-я влияния кажд.компонента на скор х.р. проводят раздельно в кисл.ср.,в р-ре соли и в р-ре основ.Для каждого компоненте состав-ют соответ. ур-е р-ции:
.Первый член отражает некатал-кое превращ-е в-ва.Для выявл-я влияния кажд.компонента на скор х.р. проводят раздельно в кисл.ср.,в р-ре соли и в р-ре основ.Для каждого компоненте состав-ют соответ. ур-е р-ции: 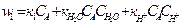 ;
;  ;
;  . Если кат.р-ции проводятся в р-рах с неидеальными св-вами,то вместо конц примен-ся актив-ти,причём скор. х.р. в завис-ти от ионной силы р-ра будет изменяться по слож.з-ну.Каталит.актив-ть слаб.к-ты может повыш-ся солями этой к-ты.Такой эффект наз-ся вторичным солевым эф-том.Нейтральные соли могут изменять каталит.действие к-ты за счёт изменения ион.силы р-ра и степени сольватации м-л и ионов в р-ре.Под воздействием м-л нейтр.соли скор.х.р. может увел-ся,умен-ся или остав-ся неизмен.При р-ции гидролиза нейтр.соли не влияют на скор.х.р.: lgkэ=lgk0.Для р-ции лигандного обмена скор.х.р. повыш-ся lgkэ=lgk0+4√j.Для р-ции окис-я брома скор.умен-ся lgkэ=lgk0-√j,где kэ,k0-константы скор в присут-вии соли и в её отсут-вии.k0=к1Кс-произвед-етистин.константы скор. И конст. Ав-сия;j-ион.сила р-ра.Изменение скор.х.р. в р-ре под действием к-ты и нейтр.соли за счёт изменения ион.силы р-ра наз-ют первич.солевым эф-том(прибавление нейтр.соли,не имеющей общего иона с катал-щей р-цию к-той).
. Если кат.р-ции проводятся в р-рах с неидеальными св-вами,то вместо конц примен-ся актив-ти,причём скор. х.р. в завис-ти от ионной силы р-ра будет изменяться по слож.з-ну.Каталит.актив-ть слаб.к-ты может повыш-ся солями этой к-ты.Такой эффект наз-ся вторичным солевым эф-том.Нейтральные соли могут изменять каталит.действие к-ты за счёт изменения ион.силы р-ра и степени сольватации м-л и ионов в р-ре.Под воздействием м-л нейтр.соли скор.х.р. может увел-ся,умен-ся или остав-ся неизмен.При р-ции гидролиза нейтр.соли не влияют на скор.х.р.: lgkэ=lgk0.Для р-ции лигандного обмена скор.х.р. повыш-ся lgkэ=lgk0+4√j.Для р-ции окис-я брома скор.умен-ся lgkэ=lgk0-√j,где kэ,k0-константы скор в присут-вии соли и в её отсут-вии.k0=к1Кс-произвед-етистин.константы скор. И конст. Ав-сия;j-ион.сила р-ра.Изменение скор.х.р. в р-ре под действием к-ты и нейтр.соли за счёт изменения ион.силы р-ра наз-ют первич.солевым эф-том(прибавление нейтр.соли,не имеющей общего иона с катал-щей р-цию к-той).
|
|
|
Билет59.Катализ КС переходных металлов и ферментатив.катализ. В кач-ве К примен-ся КС катионов переход.Ме(Vlll гр. Fe,Co,Ni,Ru,Pd и др).Сущ-ть каталит.действия заключ-ся в том,что ионы Ме с d-электрон. конфигурацией d6-d10 могут взаим-ть с др.м-ми,выступая,как акцепторы и доноры электронов.Ионы перех.Ме могут взаим-ть с несколькими лигандами.Число лигандов завис.от строения лиганда и электрон.конфигурации иона Ме.В р-ции А1+А2→А3+А4,катал-емой комплексными К,м-лы реагентов выступают как лиганды по отнош. к иону Ме. Хим.взаим-вие м\у м-ми А1 и А2,координир-ми около центр.иона Ме,облегчается благодаря поляризации м-л,понижению энергии отдельных связей и повыш.вер-ти оптимального расположения реагир.м-л.Центр.ион Ме явл-ся мостиком,облегчающим электрон. переходы м\у реагир. м-ми.Катал.актив-ть иона Ме зависит от энергии связи иона с участниками р-ции.Если эн.св. М-L велика или мала,то ион Ме прояв-ет слаб.каталит.актив-ть.В 1-ом случ. м-лы так прочно соед-ся с ионом Ме,что блокируют его и выводят из р-ции.При низ.энергии связи реагир.м-лы не смогут вытеснить из КС др. присут-щие в р-ре лиганды,при к-ром энергетич.возмущение м-л,вошедших в состав КС,недостаточно.Являясь донорами или акцепторами элек-нов,одни лиганды могут сущ-но влиять на распред-е электрон.плотности в др.реагир.м-лах,вошедших вместе с ними в состав КС,и изменять эн-ю отдел.связей.Эти св-ва лигандов и ионов Ме дают возможность регулир-я каталит.актив-ти ионов введением в коорд.сферу лигандов определ-го строения.Лиганды,повыш-щие катал.акт-ть иона Ме в дан.р-ции,наз. активаторами,пониж-щие-ингибиторами.Координационно-насыщенные КС не явл-ся актив.К. Ферменты- белки,вход.в состав клеток и тканей,кат-щие х.р.,протек-щие в орг-ме.Они отлич-ся высок. каталит.актив-тью,специфич-тью,избират-тью.Ф.к.-явление более сложное и высокоорганиз-ное,чем обыч катализ.Высок. организ-ть пр-сов ф.к. опред-ся особ-тью хим.взаим-вия в орг-ме,вызываемой сочетанием актив.центра ферм-та и субстрата.В актив.катал.центр входят группы,к-рые могут ориентир-ть м-лы субстрата в опред-ном положении по отнош. к актив.ц. Актив.ц. ф-та имеют строго опред-ную струк-ру.Они сод-т актив.гр.-доноры или акцепторы электронов.Многие в-ва оказ-ют на ф-ты активир. и ингибир. действие(ионы тяж.Ме отравляют почти все ф-ты).Каталит.актив-ть ф-тов проходит ч\з максимум при измен. рН.В сильнокисл. и сильнощел.средах ф-ты теряют катал.актив. вследствие денатурации белка.В обл.0-40ºС скор.р-ций,кат-мых ф-тами,при повыш-нии тем-ры возрастает в соот-вии с ур.Аррениуса.При тем-рах 60-70ºС белки денатурируются и полностью теряют катал.актив-ть.
|
|
|
Билет60Кинетика гомогенных катал. р-ций Гомогенными назыв. такие реакции, при котор. все реагир. в-ва и kat наход-ся в одной и той же фазе, например, в газовой или в р-ре; при этом атомы, молекулы или ионы реагирующих в-в взаимод-вуют по всему занятому объему. В этих пр-сах роль kat формально сводится к снижению Еа и, сл-но, к ускорению р-ции. Кроме того, участие kat в пр-се приводит к усложнению кинетического закона протекания р-ции. Рассмотрим для примера бимолекулярную р-цию, идущую в присут-вии kat.
A+B+K↔R1R2 ABK*. Скорость пр-са в целом опред-ся скоростью распада активного комплекса в направлении образования продуктов р-ции и регенерации kat:ABK*→R3 K+Продукты
Кон-ция активного ком-са:[ABK*]= (R1[A][B][K])/(R2+R1[A][B]
Скорость пр-са в целом:-d[A]/dt=R3*[ABK*]=(R3R1[A][B])/ /(R2+R1[A][B])*[K]
Если равновесие м/у исх. в-вами и активным комплек-сом сдвинуто в сорону активного ком-са, т.е. R1>>R2, то и R1[A][B]>>R2
-d[A]/dt=R3*[K] Если – в сторону исходных в-в, то R2>>R1[A][B] и тогда
-dA]/dt=(R3R1)/R2*[A][B][K] во всех случаях скорость пр-са пропорциональна кон-ции kat.
Билет61.З-ны Фика и роль диффузии в гетерог.катал.р-циях. Гетероген.пр-с можно разделить на 5 стадий:1)транспорт реагир.в-в к пов-ти К(диф-зия);2)адс-ция реагир.в-в на пов-ти К;3)р-ция на пов-ти К;4)десорбция продуктов р-ции с освобождением пов-ти К;5)транспорт продуктов р-ции в объёме(диф-зия).В завис-ти от условий провед-я пр-са и его особ-тей наиб.медленной стадией может быть любая из 5.Для гетероген.пр-сов особую важность приобретает перемещение в-ва из внутрен.объёма ж-ти или газа к тв.пов-ти,т.к. гетероген. хим. р-ция может протекать в том случае, если происходит непрерывная молекулярная или конвективная диффузия реагирующих в-в к поверх-ти, на кот. идет данная р-ция, и непрерывная диф-зия продуктов р-ции.Диф-ный пр-с имеет чисто физич.природу и его можно описать с пом. з-нов Фика:dn/dt=-D*S*(dc/dl) (1); dn/dt=-D*S*(d2c/dl2) (2),n-кол-во в-ва,проход-го ч\з площадку размером S за вр t;D-коэф-т мол-ной диф-зии,м2*с-1.1-ый з.Фика опр-ет,что скор. диф. пр-са в неподвижной среде в изотермич.условиях ч\з слой толщиной δ прямо пропорц-на градиенту конц-ции в-ва.Отриц.знак в (1) показ-ет убыль конц-ции;коэф-т D при малых конц-ях не завис. от конц.в-ва С. 2-ой з.Фика опр-ет скор.накопления в-ва в дан. системе за опред-ное вр.Коэф-т диф-зии опр-ся как отнош. квадрата средней длины пробега м-л ко вр.диф-зии и он обратно пропорционален давлению: D=l2сред/2t.Градиент конц. в-в в потоке можно представить в форме конечной разности: -dn/dl=(cs-cx)/l (3).Подставим (3) в (1): dn/dt=D*S*((cs-cx)/l); cs,cx- конц в-ва в объёме и у пов-ти К,моль\м3.Скорость диф-зии возрастает с повыш.тем-ры по з-ну,аналог.ур.Аррениуса: D=ke-E/RT.Но величина Е во много раз меньше Еа большин-ва х.р.→с повыш тем-ры скор.диф-зии будет расти значит-но медленнее,чем скорость х.р.
Билет62.Области протекания гетероген.катал.р-ций. Гетерогенная хим. р-ция может протекать в том случае, если происходит непрерывная молекулярная или конвективная диффузия реагирующих в-в к поверх-ти, на кот. идет данная р-ция, и непрерывная обратная диф-зия продуктов р-ции.Скор. пр-са будет опр-ся скор. лимит-щей стадии.Если скор. хим. р-ции > скор. диф-зии, то скорость пр-сса в целом будет опред-ся скор-тью диф-зии. В этом случае пр-с лежит в диф-оной области и кинетика р-ции подчиняется урав-ям, к-рые рассматр-ют пр-сы диф-зии.Пр-с при этом чаще всего опис-ся ур-ем 1-го порядка,т.к. скор.диф-зии прямо пропорц-на конц. Если скор. х. р. < скор. диф-зии, то скорость р-ции опр-ся скоростью хим. р-ции. Тогда пр-с лежит в кинетической области и описывается урав-нием кинетики той р-ции, к-рая проходит на повер-ти К. Если скорось диф. и скорость хим. р-ции, рассмотренные независимо друг от друга, соизмеримы, то имеется переходная область.Она хар-ся тем,что конц. реагир.в-в в центре зерна меньше,чем на наруж пов-ти зёрен К.В перех.обл. порядок и Еа измен-ся от измен. тем-ры,к-рое происходит от тем-ры, опр-мой кинетич.обл.,до тем-ры,хар-ной для диф.обл.Большое влияние на хар-р протекания гетер.х.р. оказ-ют давления реагир.в-в,скор. потоков,пористость К и тем-ра.При изменении тем-ры на 10ºС скор. диф-зии измен-ся ≈в 1,2 раза, а скор.х.р.- в 3-4раза→при понижении тем-ры скор.х.р. убывает быстрее,чем скор. диф-зии,и при низких тем-рах пр-с чаще протекает в кинетич.обл.Если не все участки пов-ти, на к-рой протекает р-я в равной степени доступны для реагир.м-л,то часто оказ-ся,что на части пов-ти р-я протекает в кинетич.обл,а на остальной-в диф-ной.При проведении р-ции на неравнодоступ.пов-ти возмож.4 обл. 1)Внеш.диф.обл. (Скор.диф. м-л к внеш. пов-ти К-лимит.ст).Внешдиф.обл. проявл-ся,когда пр-с проводится при повыш. тем-рах,при наличии у пов-ти К плёнки,затруд-щей подход м-л реаг-тов к актив.ц. К,при проведении пр-са в присут-вии высокоактив.К. В случ. внеш.диф. конц-ии регаир.в-в на пов-ти пористого тела и внутри пор гораздо меньше,чем в объёме. 2)Внутр.диф. При таком режиме конц. реагир. в-в у внеш.пов-ти пористого К близки к конц. их в объёме;конц в порах уменьш-ся от наруж. пов-ти зёрен пористого К к их центру,а конц. прод.р-ции соот-но возрастает.Кин-ка пр-са завис. от соотнош. внеш и внутр пов-ти;если они соизмеримы,то кин-ка соот-ет промеж.обл.Внутридиф.пр-сы опис-ся ур-ем массопереноса: wм.п.=β∙S(cп-соб),β=D/l-коэф-т массопер-са; cп-конц в-ва у пов-ти,на входе в пору,соб-конц в-ва в объёме пор. 3)Внеш.кинетич.обл. (Скор. х.р. м\у адсорбир.в-ми на внеш. пов-ти К гораздо меньше скор. пр-сов на др. стадиях). Конц. реагир. в-в на пов-ти К и в объёме равны,но р-я протекает т-ко на внеш пов-ти К.Кин-ка пр-са опр-ся кин-кой х.р.Состав-ся ур-я завис-ти скор.х.р. от тем-ры, конц К и др.параметров. 4)Внутр.кинетич.обл. (наиб медл.стадия-ст. хим. превращ-я м-л реагентов,адсорбир-ных на актив.ц. внутри пор К).При таком режиме конц в-в в объёме,на пов-ти К и внутри пор одинаковы.Кин-ка опр-ся к-кой пр-са.Скор.пр-са зависит от всей пов-ти К(внутр. и внеш).А во внешнекин.обл. т-ко от внеш.
Билет63.Кин-ка гетероген.кат.р-ций,к-рые не тормозятся продуктами р-ции. Будем рассмат-ть р-ции на тв.К,в к-рых реагир.в-ва и продукты р-ции газообраз.В типич.гетероген.пр-се регир-ют т-ко те в-ва,к-рые адсорбир-ны на пов-ти.Скор.гет.х.р. опр-ся как кол-во в-ва,реагир в ед. вр. на ед. площади пов-ти К:υ=dx/Sdt,x-кол-во в-ва,прореагир. к моменту вр t,моль;S-общ.площадь пов-ти К,на к-рой идёт х.р.Скор. гет.х.р. прямо пропорц-на пов-ной конц в-в,к-рая прямо пропорц-на степени заполнения пов-ти θ→ dx/Sdt=θ.Т.к. пов-ть дан.К постоянна, то величину общ.пов-ти К можно ввести в константу скор.k’, т.е. k’S=k → dx/dt=kθ(1).Величину пов-ти,занятую реагир.в-вом на 1 см2 пов-ти К,можно найти,исходя из ур-я:θ=Kp/(1+Kp)(2),p-дав-е газа,К-константа рав-сия адсорб-ции(адсорб.коэф-т).Из(2) след.,что если адс-ция мала,то θ<<1,и К<<1,поэтому Кр в знаменателе пренебрегаем.Тогда из (2): θ=Кр(3),т.е. при малых дав-ях пов-ть,занятая адсорбир. в-вом,прямо пропорц-на дав-ю.Эта обл. наз-ся обл-тью линейной адс-ции.Если адс-ция велика,то Кр>>1,и в знаменателе (2) пренеб-ем 1→θ=1(4)-ур-е асимптоты кривой,опис-мой ур-ем (2).Если реаг-ет одно в-во и его адс-ция мала,то,подставив в (1) знач-е θ из(2):dx/dt=kKp(5).Пусть kK=k*→выр-е (5) примет вид:dx/dt=k*p(6). p=ni/V *RT=(n0-x)/V *RT(7),ni= n0-x-число грамм-мол-л исх.в-ва в момент вр. t,n0-в начальн.момент,V-общ объём системы.Подставим (6) в (5) и получим ур-е,удобное для интегрирования(k*-кажущаяся константа скор.пр-са).Подставим (2) в (1): dx/dt=k*∙(p/1+Kp).Это выр-ние соответ-ет случаям,когда реагир.в-во адсорб-ся умеренно:dx/dt=k*p1/n.Такой дробный порядок явл-ся кажущимся.Он получ-ся,т.к. в кин-кое ур-е вводим величины,хар-щие изменение конц.в-ва не непосред-но на пов-ти,а в объёме.В наше выр-е входит не пов-ная конц,хар-мая велич.θ,а величина,хар-щая сод-е реагир.в-ва в объёме-его парциальное дав-е р.Если реагир. в-во сильно адс-ся,то θ=1,тогда подставив (4) в (1):dx/dt=k(кажущ-ся порядок равен 0,р0=1).
Билет64.Связь м\у истинной и кажущ-ся энериями активации. Если построить на основании экспер-ных данных график завис-ти кажущ-ся константы скорости k* от 1/T,то получ-ся прямая,опис-мая ур-ем:lnk*=-E*/RT+lnc или dlnk*/dt=E*/RT2(1),где E*-кажущ-ся Еа.Найдём завис-ть м\у Еа и E*. k*=kK.Адсорбцион.коэф-т(константа рав-сия) К равен отнош. констант скоростей пр-сов адс-ции и десорб-ции:К=k1/k2, k*=k∙ k1/k2(2).Каждая из констант,входящих в (2),явл-ся функцией тем-ры.Т.к. k1=C’/√T(C’-величина постоянная), k2=C”e-λ/RT(3)(C”-велич.постоян.,λ-т-та адсорбции),k=Ce-E/RT(4).Константа скорости пр-са адс-ции k1 с тем-рой измен-ся очень мало по срав-ю с k и k2.Завис-тью k1 от тем-ры можно пренебречь и считать,что эта величина постоянная.Подставив (3) и (4) в (2):k*=Ce-E/RT∙k1/(C’e-λ/RT)→lnk*=-E/RT+λ/RT+lnconst (const=Ck1/C’). Дифференц-ем по Т:dlnk*/dT=(E-λ)/RT2(5)/Сравнивая (5) и (1),видим: Е*=Е-λ(6).Это выр-е хар-ет завис-ть кажущ-ся Еа от истин. Е* меньше Еа на величину т-ты адс-ции реагир.в-ва.Для простешей р-ции А→В на пов-ти тв.К можно выделить  стадии:А→Аадс→А*адс →Вадс→В. Вначале м-лы в-ва А адс-ся на пов-ти тв.К,преодолевая энерг.барьер Еадс.Выделяя избыток энергии в форме т-ты адс-ции,м-ла может перейти в более уст-вое адсор-ное сост.Аадс.На новом кат-ком центре или под воздействием актив.центра К м-ла А может перейти в электронно-возбуждённое сост с переходом на энергетический барьер высотою Еист.(А*адс).Возбуждённые м-лы А,скатываясь в ложбину продукта р-ции,превращ-сяв прод.р-ции.При этом м-ла В переходит в адсорбир.сост.Для десорбции м-лы В с актив.ц. ей необх-мо преодолеть энергию ЕВадс.После чего м-ла В может уйти с каталит.центра в объём реакцион.смеси.
стадии:А→Аадс→А*адс →Вадс→В. Вначале м-лы в-ва А адс-ся на пов-ти тв.К,преодолевая энерг.барьер Еадс.Выделяя избыток энергии в форме т-ты адс-ции,м-ла может перейти в более уст-вое адсор-ное сост.Аадс.На новом кат-ком центре или под воздействием актив.центра К м-ла А может перейти в электронно-возбуждённое сост с переходом на энергетический барьер высотою Еист.(А*адс).Возбуждённые м-лы А,скатываясь в ложбину продукта р-ции,превращ-сяв прод.р-ции.При этом м-ла В переходит в адсорбир.сост.Для десорбции м-лы В с актив.ц. ей необх-мо преодолеть энергию ЕВадс.После чего м-ла В может уйти с каталит.центра в объём реакцион.смеси.
|
|
|


