 |
Современные представления о строении и формировании амилоидных фибрилл
|
|
|
|
Амилоидные отложения состоят из фибриллярных белков связанных с полисахаридами и другими компонентами. Физико-химические особенности амилоида определяют его тинкториальные свойства, выявляемые при использовании красителя Конго красного, тиофлавина Т или S.
Таким образом, термин "амилоидоз" объединяет болезни, которые характеризуются отложением белковых масс, имеющих фибриллярную ультраструктуру и обладающих двойным лучепреломлением в поляризованном свете. Значительный прогресс в выяснении структурных свойств амилоидных фибрилл был сделан с помощью рентгеновской дифракции фибриллярного материала, выделенного из биологических тканей, а также сформированного in vitro (Blake et al., 1996; Blake & Serpell, 1996; Sunde & Blake, 1997). Эти исследования показали, что все амилоидные фибриллы имеют β-складчатую структуру с отдельными β-слоями, ориентированными параллельно главной оси фибриллы. Это означает, что белок-предшественник амилоидов, не имеющий такой структуры, подвергается молекулярным перестройкам.
На сегодняшний день известно более 20 белков, образующих амилоидные фибриллы in vivo и участвующих в патогенезе амилоидозов (таблица 2), а также белки, амилоиды которых изучены только in vitro (таблица 3) (Uversky & Fink 2004). Аβ-пептид, инсулин, лизоцим, транстиретин, амилин, хантингтин, тау-белок, α-синуклеин, миоглобин, и другие различаются между собой по аминокислотным последовательностям, вторичным и третичным структурам. Однако, несмотря на это, образованные ими амилоидные фибриллы имеют β-складчатую структуру. Эксперименты in vitro со многими белками показали, что перед образованием амилоидов структура их молекул должна претерпевать трансформацию типа «α-спираль – β-складчатость», что, как правило, требует длительной инкубации и жестких условий, несовместимых с условиями in vivo: низкие значения рН, высокие температуры, добавление ряда веществ, не присутствующих в клетке и т.п., Белки-предшественники амилоидов могут иметь β-структуру, или α-спираль или содержать обе структуры. Переход растворимой формы прионного белка в фибриллярную сопровождается уменьшением содержания α-спирали и увеличением β-структуры. Аβ-пептид при образовании амилоидных фибрилл также претерпевает трансформацию структуры от α-спирали к β-структуре. Все эти данные указывают на то, что белки, вторичная структура которых представлена α-спиралью, претерпевают трансформацию типа "α-спираль – β-структура" до или во время образования фибрилл. Однако процесс фибрилообразования не всегда требует перехода α-спирали в β-структуру. Так, белок транстиретин представляет собой тетрамер, где каждая субъединица содержит только β-структуру, а молекула α-синуклеина в нативной форме представляет собой развернутую структуру. К таким белкам можно отнести и исследуемые нами белки семейства тайтина, содержащие >90% β-cкладчатости.
|
|
|
Таблица 2.
Амилоидогенные белки и пептиды участвующие в патогенезе амилоидозов (см. ссылки в обзоре Uversky & Fink 2004).
| Амилоидогенный белок | Тип структуры | Заболевание | Место накопления амилоидных фибрилл |
| β-амилоид и его пептиды | α-спираль | болезнь Альцгеймера | мозг |
| тау-белок | развернутый | болезнь Альцгеймера, болезнь Паркинсона | мозг |
| транстиретин | β-структура | сенильный системный амилоидоз, наследственная амилоидная полинейропатия | во всех органах и тканях |
| хантингтин | α-спираль | болезнь Хантингтона | мозг |
| легкие цепи иммуноглобулинов | β-структура | амилоидоз ассоциированный с легкими цепями | во всех органах и тканях |
| аполипопротеин А1 | α-спираль | наследственный системный амилоидоз | глаза |
| лизоцим | α-спираль + β-структура | наследственный системный амилоидоз | внутренние органы и ткани |
| α-синуклеин | развернутый | болезнь Паркинсона, деменция с тельцами Леви | мозг |
| амилин | развернутый | диабет второго типа | печень |
| фибриноген и его фрагменты | β-структура | наследственный почечный амилоидоз | почки |
| β2-микроглобулин | β-структура | амилоидоз связанный с гемодиализом | опорно-двигательная система, сердце мочеполовая система, периферическая нервная система, желудочно-кишечный тракт |
|
|
|
Продолжение таблицы 2.
| гелсолин | α-спираль + β-структура | наследственный системный амилоидоз | отдельные внутренние органы и ткани |
| кальцитонин | развернутый | медуллярный рак щитовидной железы | щитовидная железа |
| медин | β-структура | амилоидоз аорты | аорта |
| сывороточный амилоид А и его фрагменты | α-спираль + β-структура | АА амилоидоз | желудок, щитовидная железа, почки |
| цистатин С | α-спираль + β-структура | наследственная цистатин С амилоидная ангиопатия (болезнь кровеносных или лимфатических сосудов) | мозг |
| инсулин | α-спираль | подкожнолокализованный амилоидоз | кожа, мышцы |
Таблица 3.
Амилоидогенные белки и пептиды, к настоящему времени не связанные с болезнями (см. ссылки в обзоре Uversky & Fink 2004).
| Амилоидогенный белок | Тип структуры | Амилоидогенный белок | Тип структуры |
| бетабелин 15D и 16D | β-структура | миоглобин | α-спираль |
| цитохром с552 | α-спираль | мышечная ацилфосфатаза | α-спираль + β-структура |
| SH3-домен | β-структура | Аполипопротеин С II | развернутый |
| β-лактоглобулин | β-структура | протимозин α | развернутый |
| ацилфосфатаза | α-спираль + β-структура | метионин аминопептидаза | α-спираль |
Процесс олигомеризации и фибриллообразования происходит при взаимодействии молекул белка за счет электростатических, водородных и гидрофобных взаимодействий с образованием димеров – начальных строительных блоков (рис. 4). Например, значительный вклад в фибриллогенез Аβ-пептида вносят гидрофобные взаимодействия. Дальше димеры олигомеризуются в тетрамеры, октамеры и т. д. с образованием протофибрилл шириной 2–3 нм и длиной до 200 нм. Эти образования накапливаются в лаг-фазе, характерной для кинетики фибриллообразования. Окончание лаг-фазы связано с образованием протофибриллами фибрилл диаметром 7–8 нм. События, происходящие в лаг-фазе, представляют большой интерес, так как именно на этой стадии с помощью микроскопа можно наблюдать кинетику фибриллогенеза, а также морфологию постепенно формирующихся агрегатов (т. е. динамику процесса) (Zerovnik, 2002). Причем, один и тот же белок может образовывать амилоидные агрегаты разной морфологии, т. е. обладать полиморфизмом, как например, Аβ(1-40)-пептид, который образует зрелые структуры разного типа (рис. 5), такие как "ветвящиеся", "спиральные" и "ленточные" (Goldsbury et al., 2000). Полиморфизм был показан и для других белков, таких как амилин (Goldsbury et al., 1997), кальцитонин (Bauer et al., 1995), инсулин (Jimenez et al., 2002).
|
|
|
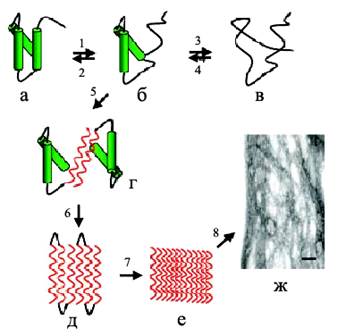
Рис. 4. Образование амилоидных фибрилл: (а) – нативная структура белка, (б) – промежуточное состояние, в котором части полипептидной цепи находятся в ненативной конформации, (в) – полностью развернутое состояние, (г) – образование межмолекулярного β-слоя, опосредованное развернутыми областями приводит к олигомеризации белка, (д) –дальнейшее образование β-складчатой структуры, (е) – образование протофибрилл, (ж) –формирование зрелых фибрилл (Jobansson, 2003).
Чемберлейн в 2000 г. показал, что фибриллы, образованные различными белками, обладают сходными структурными свойствами: все они образованы из протофибриллярных нитей, имеющих 2–5 нм в диаметре и содержащих от двух до пяти β-слоев. При этом размеры протофибрилл никак не связаны с количеством аминокислотных остатков белка-предшественника фибриллообразования. Так протофибриллы SH3 домена, включающего 90 аминокислотных остатков, состоят из двух β-слоев, а лизоцим, состоящий из 130 аминокислотных остатков, образует протофибриллярные нити, содержащие четыре β-слоя (Chamberlain et al., 2000).
|
|
|


