 |
Энтеропатии с потерей белка у собак.
|
|
|
|
Бобровский М.А., Ветер Д.С., Масимов Э.Н.
Отделение терапии инновационного ветеринарного центра московской ветеринарной академии.
PROTEIN-LOSING ENTEROPATHY IN DOGS
M.Bobrovskiy, D.Veter, E.Masimov.
Department of internal medicine IVC MVA.
Энтеропатии с потерей белка (PLE) - это синдром, характеризующийся хронической потерей белка в просвет желудочно-кишечного тракта животных. PLE достаточно редко встречается у человека, однако это довольно распространенное осложнение встречающееся у собак и намного реже у кошек. Наиболее подверженными к данному синдрому породами собак, являются йоркширские терьеры, ротвейлеры, немецкие овчарки, норвежские лундехаунды, золотистые ретриверы, басенджи, боксеры, ирландские сеттеры, пудели, мальтезы и шарпеи. Авторы статьи не выявили достоверной корреляции PLE с определенным полом и возрастом животных. Однако в одном исследовании сообщалось, что в 61% случаев PLE у йоркширских терьеров, это были самки; средний возраст животных составлял 7.7 ± 3.0 лет [5].
Как правило, данный синдром может развиться на фоне воспалительных заболеваний кишечника (лифоцитарно-плазмоцитарного, эозинофильного энтерита и д.р.), лимфангиэктазии, лимфомы кишечника, грибкового поражения (гистоплазмоза), острого бактериального или вирусного энтеритов, аутоиммунных заболеваний кишечника и некоторых других патологических процессах. При этом клиническая картина может выглядеть несколько вариабельно, в зависимости от этиологии заболевания. Среди общих клинических признаков, отражающих наличие PLE, можно выделить следующее:
● Хроническую, реже острую, диарею.
● Разной степени выраженности кахексию.
● Хроническую рвоту. (Рвота - достаточно частый симптом.Однако она может отсутствовать у некоторого процента пациентов или присутствовать на сравнительно поздних этапах заболевания).
|
|
|
● Ухудшение или полное отсутствие аппетита.
● Периферические отеки конечностей.
● Наличие асцита, в более редкихслучаях гидроторакса.
Последние два симптома, обусловлены снижением онкотического давления крови, вследствие гипоальбуминемии (15-25 г/л). Животные с хронической диареей и рвотой, при несвоевременном обращении владельцев, могут поступать с симптомами анемии (от умеренной до ярко выраженной), дегидратации, гиповолемии/гиповолемического шока. Одышка и признаки дыхательной недостаточности, могут наблюдаться у пациентов со скоплением значительного количества жидкости в грудной полости. Пальпация может выявить от умеренной до выраженной болезненность брюшной стенки, признаки флуктуации, объемные образования. В ходе проведения аускультации, возможно выявление признаков гидроторакса в виде приглушения звуков сокращения сердца. Следует отметить, что не у всех собак с PLE, присутствует выраженные клинические признаки; единственными симптомами могут быть снижение веса и гипоальбуминемия.
Во всех случаях гипоальбуминемии, с характерными для PLE клиническими признаками, проводимая диагностика должна быть достаточно агрессивной т.к. этиология синдрома разнообразна, а детальная проработка и исключение каждого заболевания по отдельности, а также оценка результативности эмпирически-назначенной терапии может занять достаточно много времени. Первой диагностической задачей, является установление причины потери белка. Исследование кожи необходимо для исключения поражений, способных привести к потере белка. Как правило, поражения кожи способные вызвать гипоальбуминемию, достаточно очевидны при первичном осмотре (например ожоги большой площади). Быстрый осмотр позволяет выяснить, действительно ли кожа является причиной гипоальбуминемии [1].
|
|
|
Следующим этапом диагностики является исключение нарушения синтеза альбумина печенью и потеря белка с мочой, вследствие нефропатий. Необходимо получить образцы мочи для проведения общего клинического анализа и оценки соотношения белок-креатинин, с целью установления факта протеинурии. В случае наличия серьезной нефропатии, у собак может наблюдаться разной степени выраженности азотемия. Исследование функции печени, должно включать определение уровня желчных кислот. Концентрация аминотрансфераз зачастую возрастает при разрушении гепатоцитов, однако интерпретация значений активности АЛТ, АСТ, ГГТ и ЩФ, должны проводиться с осторожностью, так как у некоторых собак с тяжелыми, хроническими заболеваниями печени, не отмечается высокого уровня гепатоцеллюлярных ферментов [4]. Уровень глобулинов может сохранятся на нормальном уровне или быть незначительно повышен например в случае гистоплазмоза. Абсолютнаягипопротеинэмия встречается реже, в основном на поздних стадиях заболевания. Гипохолестеринемия в сочетании с гипоальбуминемией, более характерна для PLE (вторично к хронической мальабсорбции) или печеночной недостаточности. В тоже время гиперхолестеринемияв сочетании с гипоальбуминемией, наводит на мысли о потери белка вследствие нефропатии[M1] [1]. Снижение уровня сывороточного кальция (общего и ионизированного) имеет многофакторную этиологию, ассоциированную со снижением альбумина как основного транспортного белка, снижением усвоения витамина D и нарушением усвоения магния. В клиническом анализе крови может наблюдаться лимфопения, особенно в случаях лимфангиэктазии; достаточно часто можно встретить признаки регенераторной, анемии, вследствие снижения усвоения железа и цианокобаламина.
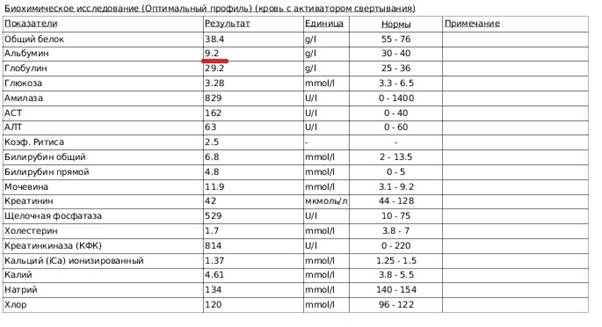
Рис 1. Биохимический анализ крови

Рис 2. Клинический анализ крови
После исключения нарушений функций печени или заболеваний почек, при концентрации альбумина 15-25≤ г/л, PLE является разумным первичным диагнозом. Измерение ингибитора α1-антитрипсина (α1-протеазы) в образцах кала, может использоваться для дальнейшего подтверждения PLE [4]. α1-антитрипсин имеет молекулярный вес, сходный с альбумином. Этот белок находиться в сосудистом и интерстициальном пространстве, в лимфе. В отличие от альбумина и других белков плазмы, α1-антитрипсин способен противостоять разложению кишечными и бактериальными протеазами. При PLE, могут наблюдаться потери α1-антитрипсина в просвет кишечника и выведение его с калом, что может быть определено методом иммуноферментного анализа. Данный тест достаточно трудоемок в плане соблюдения точной методологии забора, хранения и транспортировки образцов. Определение α1-антитрипсина в кале, является полезным исследованием как для непосредственной диагностики PLE, так и для уточнения диагноза в случае сочетанного течения PLE с печеночной недостаточностью или нефропатией. Однако интерпретация результатов данного исследования может вызвать определенные сложности. В целом этот тест редко используется в клинической практике. На территории РФ, данное исследование не проводится.
|
|
|
Еще одним точным методом диагностики [M2] PLE, является определение количества меченого изотопом хром-51 альбумина в кале, после его внутривенного введения. Практическое применений данного теста, также ограничено.
Последующая диагностика должна быть направлена на выявление этиологии текущей энтеропатии. Проведение рентгенологических исследований, в том числе рентгеноконтрастных исследований ЖКТ, как правило являются мало информативными. Ультразвуковая диагностика является полезным исследованием для обнаружения специфических изменения кишечной стенки. Например утолщение стенки кишечника и наличие гиперэхогенных полос в подслизистом слое может свидетельствовать о наличии лимфангиэктазии [1]. Еще более выражено эти признаки наблюдаются в случае приема жирной пищи накануне исследования, что приводит к большему расширению лимфатических сосудов стенки кишечника. Ультразвуковая диагностика может выявить очаговые изменения, не доступные для эндоскопической визуализации.
Исследование кала может выявить наличие яиц паразитов или простейших. Судановое окрашивание кала используется для определения стеатореи, что указывает на плохое усвоение жиров. Цитологическое исследование мазков фекалий может выявить гифы грибов.
|
|
|
Окончательный диагноз устанавливается после забора биоптатов для проведения гистологического исследования. Биопсия может быть выполнена посредством ЭГДС, лапаротомии или эндоскопически-ассистированной лапаротомии. Выбор того или иного метода забора биопсии зависит от многих факторов,таких как наличие эндоскопических навыков, наличие данных о вероятной локализации патологического очага, наличия необходимого эндоскопического оборудования и д.р.. Из преимуществ проведения лапаротомии, можно выделить возможность полнослойного забора биоптата а также возможность забора материала из нескольких сегментов кишечника, недоступных в случае применения гибкой эндоскопии. Однако понятие “полнослойный материал” не является синонимом “диагностически значимый”. Большое внимание должно быть уделено наложению серозно-мышечных швов, которые в случае PLE, могут представлять угрозу из-за длительной регенерации, и угрозы несостоятельности шва. Во многих случаях очаги поражения невозможно увидеть со стороны серозной оболочки а т.к. некоторые причины PLE могут быть локально расположены в разных отделах кишечника, важно иметь возможность визуализировать их со стороны слизистой оболочки [1]. В случае же забора материала во время проведения гибкой эндоскопии, возможно выявить характерные изменения слизистой оболочки кишечника и провести точечный забор материала. Забор материала нужно осуществлять из нескольких отделов кишечника, стараясь взять не менее 5-6 образцов из двенадцатиперстной и подвздошной кишки (по данным Willard, M., статистически, данный отдел кишечника наиболее часто вовлекается в патологический процесс приводящий к развитию PLE). Несмотря на то, что окончательный диагноз будет поставлен на основании патоморфологии, в некоторых случаях можно поставить предварительный диагноз (как в случае лимфангиэктазии) опираясь на характерные изменения слизистой оболочки, обнаруживаемые при эндоскопическом исследовании (многочисленные, диффузные, расширенные лимфатические сосуды, могут быть визуализированы как большие белые везикулы на слизистой оболочке). Признаки дилатации лимфатических сосудов, лучше визуализируются при скармливании жирной пищи перед проведением исследования.
Стратегия лечения PLE основывается на выборе адекватной нутрицептивной терапии и контроле уровня воспаления. В случае постановки диагноза на ранних стадиях диагностики, при выявлении очевидных патогенетических факторов (наличие в образцах кала простейших, яиц гельминтов или выявление возбудителей парво/ коронавирусного энтеритов в ректальных смывах), необходимо сосредоточить внимание на лечении выявленной патологий согласно действующим рекомендациям.
|
|
|
Животные поступившие с нестабильными показателями гемодинамики, в состоянии шока, нуждаются в проведении интенсивной терапии. Классический подход к проведению интенсивной терапии животным с гиповолемическим шоком (особенно в случае наличия выпота в анатомические полости или периферическими отеками мягких тканей, свидетельствующих о возможном низком онкотическом давлении), будет отличаться тем, что быстрое введение больших объемов кристаллоидов до введения коллоидов может быть необоснованным из-за низкого онкотического давления и неспособности вследствие этого удержать вводимый объем жидкости. Болюсное введение кристаллоидов, в начале терапии, должно быть скорректировано в сторону уменьшения объемов и увеличения времени введения или должно проводиться максимально аккуратно при наличии лабораторно подтвержденных сведений о концентрации альбумина. Коллоидным раствором выбора, может являться волювен в дозировке 5-10мл/кг [M3] или альбумин 0.5-1г/кг в/в. В последующей терапии, также может потребоваться дополнительное введение альбумина, для поддержания онкотического давления крови. Многие пациенты поступают в состоянии от умеренной до выраженной дегидратации вследствие острой/хронической диареи и/или рвоты, и поэтому им, параллельно со стабилизацией гемодинамики, должна быть проведена адекватная инфузионнаятерапиия, направленная на регидратацию. Проведение торакоцентеза, и удаление жидкости из грудной полости целесообразно в тех случаях, когда скопление ее значительных объемов, могут приводить к развитию дыхательной недостаточности. Назначение фуросемида в таких случаях нецелесообразно и может привести к усугублению дегидратации и снижению ОЦК. В некоторых случаях сильной анемии (RBC 2-3 х 1012/л<; HCT 20%<; HGB 100 g/l<), может потребоваться проведение гемотрансфузии.
Во всех случаях неустановленной или не до диагностированной PLE, целесообразным считается назначение эмпирической терапии. В значительном количестве случаев, такая терапия может привести к нивелированию острых симптомов заболевания и стабилизировать общее состояние животного. Однако, важно не останавливаться в поисках этиологических факторов, удовлетворившись положительной динамикой лечения. В случае некоторых энтеропатий, целесообразным является назначение антибактериальных препаратов (например сочетание метронидазола 15мг/кг каждые 12ч и тилозина10-15мг/кг по.) [2]. В случае ВЗК, целесообразно назначение стероидных противовоспалительных препаратов - преднизолон 1-2мг/кг каждые 12-24 часа [3]. Однако решение о назначение иммуносупрессивной терапии, должно приниматься с осторожностью. Купирование рвоты можно осуществлять введением маропитанта - 1мг/кг, п/к. Животным с PLE, необходимо дополнительное введение цианокобаламина, из-за нарушения его синтеза и усвоения вследствие мальабсорбции. Дополнительное введение цианокобаламина, будет способствовать коррекции легкой и умеренной анемии. Рекомендуемая суточная доза цианокобаламина– 250-500 мкг, в/м каждые 24 часа.
Нутрицептивная терапия заключается в назначении легкоусвояемых кормов с низким содержанием жира для предотвращения дальнейшей лимфангиэктазии. Рекомендовано назначение высококалорийных кормов с большим количеством легкоусвояемых белков и низким содержанием сырой клетчатки. У собак с IBD, многими специалистами отмечена положительная динамика при назначении кормов, содержащих гидролизованные белки [6]. В случае отсутствия аппетита более 72 часов, необходимо произвести установку назоэзофагогастрального зонда или сформировать эзофагостому, для обеспечения энтерального питания. Назначение правильного, диетического питания является очень важным в терапии PLE! В некоторых случаях легкой и умеренной PLE, нутрицептивная терапия позволила стабилизировать состояние пациентов, без назначения фармакотерапии.
Список используемой литературы:
1. “Canine Protein Losing Enteropathies” - Willard, M.; Texas A&M University, Department of Small Animal Clinical Sciences, College of Veterinary Medicine, Texas, USA.
2. “Diagnosis and Management of Chronic Enteropathies in Dogs” - Kenneth W. Simpson BVM&S, PhD, DipACVIM, DipECVIM-CA; College of Veterinary Medicine, Cornell University, Ithaca, NY.
3. “Protein losing enteropathy in dogs - the beginning of end?” - FrédéricGaschen, Dr.med.vet.,Dr.habil., DACVIM and DECVIM-CA; Dept. of Veterinary Clinical Sciences, Louisiana State University School of Veterinary Medicine.
4. “Diagnosis and management of protein-losing enteropathy” - Stanley L. Marks, BVSc, PhD, DACVIM (Internal Medicine, Oncology), DACVN Professor of Small Animal Medicine, Associate Director of the Small Animal Clinic University of California, Davis, School of Veterinary Medicine, Davis, CA, USA/
5. “Protein losing enteropathy in Yorkshire Terriers – Retrospective study in 31 dogs” - D. BOTA1, A. LECOINDRE2, A. POUJADE3, M. CHEVALIER4, P. LECOINDRE2, F. BAPTISTA5, E. GOMES1, J. HERNANDEZ1*; 1 Centre HospitalierVétérinaireFregis, 43 av. Aristide Briand, 94110 Arcueil, France; 2 Clinique des Cerisioz, Route de Saint-Symphorien-d’Ozon 69800 Saint-Priest France; 3 Laboratoired‘AnatomiePathologiqueVétérinaire du Sud-Ouest, 129, route de Blagnac 31201 Toulouse cedex 2, France; 4 LaboratoireBiomnis, 17/19 avenue Tony Garnier, 69007 Lyon, France; 5 StemCell2Max Biocant Park Nucleo 04, Lote 02 3060-197 Cantanhede Portugal.
6. “Medical and nutritional management of protein-losing enteropathy” - Jane Armstrong, DVM, MS, MBA, DACVIM; University of Minnesota St. Paul, MN
[M1]Изменено
[M2]Изменено
[M3]Изменено
|
|
|


