 |
Применение бишофита для тушения лесных и степных пожаров, а также деревянных строений и в качестве огнезащитного средства
|
|
|
|
Физические и химические свойства
Магний – серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. На воздухе он покрывается тонкой оксидной пленкой, придающей ему матовый цвет. Кристаллическая решетка магния относится к гексагональной системе.
Щелочноземельные металлы плохо проводят электрический ток; почти все они неустойчивы на воздухе, активны, легко растворяются в разбавленных кислотах, при нагревании энергично реагируют с кислородом, водородом, азотом, углеродом, галогенами, серой, фосфором и др.
На магний не оказывают заметного действия дистиллированная вода, фтористоводородная кислота любой концентрации, водные растворы фтористых солей, сера (жидкая и газ), сернокислый алюминий, сероуглерод, растворы едких щелочей, углекислая щелочь, сухие углеводороды, органические галогенпроизводные, не содержащие спирта и H2O, безводная C2H5OH, этиловый и уксусный эфиры, жиры и масла, не содержащие кислот, ароматические соединения и минеральные масла.
Разрушающе действуют на магний морская и минеральная вода, водные растворы HCl, H2SO4, HNO3, H3PO4, кремнефтористоводородные кислоты, водные растворы галоидных солей, сернистых соединений, NH3, его водные растворы, NxOy, растворы двууглекислой соды, органические кислоты, водные и спиртовые растворы хлорметила и хлорэтила, метиловый спирт, гликоли и гликолевые смеси, многие альдегиды.
При комнатной температуре на воздухе компактный магний химически стоек.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 - бишофит, натрия NaCl и калия KCl.
В расплаве электрохимическому восстановлению подвергается хлорид магния:
|
|
|
MgCl2 (электролиз) = Mg + Cl2.
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья.
Строение и свойства атома
В периодической системе элементов магний располагается в главной подгруппе II группы; его порядковый номер – 12, атомный вес 24,312. Электронная конфигурация невозбужденного атома – 1s22s2p63s2; валентные электроны наружного слоя определяют валентность +2 и объясняет типичный характер восстановительных реакций, в которые вступает магний. Строение внешних электронных оболочек атома Mg (3s2) соответствует его нульвалентному состоянию. На внешнем электронном уровне атома содержатся только 2 электрона, которые легко отдаются для образования стабильной 8-электронной конфигурации, в результате чего образуются двухвалентные положительно заряженные ионы магния. Поэтому химически магний очень активен, на воздухе окисляется, но образующаяся при этом на поверхности окисная пленка отчасти препятствует дальнейшему окислению
ОКСИД МАГНИЯ
Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике, нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C.температура кипения — 3600 °C.Плотность=3,58 г/см3.
Химические свойства
Легко реагирует с разбавленными кислотами и водой с образованием солей и Mg(OH)2:


Получение
Оксид магния получают обжигом минералов магнезита и доломита.

ГИДРОКСИД МАГНИЯ
Получение
§ Взаимодействие растворимых солей магния с щелочами:
В общем виде:

Примеры:

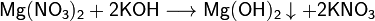
§ Взаимодействие раствора хлорида магния с обожжённым доломитом:

§ Взаимодействие металлического магния с парами воды:
|
|
|

Химические свойства
§ Разложение при нагревании до 350 °C:

§ Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):


§ Взаимодействие с кислотными оксидами с образованием соли и воды:
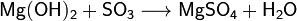
§ Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов:

Большинство солей магния хорошо растворяются в воде. Процесс растворения сопровождается незначительным гидролизом. Полученные растворы имеют слабокислотную среду:
[Mg(H2O)6]2+ + H2O  [Mg(H2O)5(OH)]+ + H3O+
[Mg(H2O)5(OH)]+ + H3O+
Соединения магния со многими неметаллами, в том числе с углеродом, азотом, фосфором, серой необратимо гидролизуются водой.
Применение
Применение бишофита для тушения лесных и степных пожаров, а также деревянных строений и в качестве огнезащитного средства
- способствует улучшению обмена веществ у животных и более эффективному использованию кормовых средств.
Эффективность применения бишофита в растениеводстве:
- повышение продуктивности плодово-ягодных культур и устойчивости к вредителям и болезням;
- повышение урожайности, содержания сахара;
- улучшение вкусовых качеств;
- продукция не содержит остаточных токсических веществ;
- восполняет дефицит макро- и микроэлементов
|
|
|


