 |
Количество теплоты, необходимое для плавления вещества
|
|
|
|
Изменения агрегатных состояний вещества
ПЛАН
1. Переходы между агрегатными состояниями
2. Плавление и отвердевание
3. Испарение и конденсация.
Ключевые понятия и термины:
плавление
отвердевание (кристаллизация)
парообразование
испарение
кипение
конденсация
сублимация (возгонка)
десублимация
удельная теплота плавления
удельная теплота парообразования
Слово агрегатный произошло от латинского слова aggrego (связываю, соединяю). Рассматривать основные агрегатные состояния веществ удобно на примере воды, которая в наших естественных земных диапазонах температур может находиться в трех состояниях (рис. 1): жидком (вода), твердом (лед или снег), газообразном (пар).



Рисунок. 1. Агрегатные состояния воды: лед, вода, пар
Отличия между агрегатными состояниями воды состоят в том, что частицы (молекулы) по-разному расположены друг относительно друга: на различных расстояниях и взаимодействуют по-разному. Кроме того, они еще с различной активностью двигаются: или свободно перемещаются, или частично связаны, или находятся в строго определенных положениях и колеблются относительно них.
1. Переходы между агрегатными состояниями
Важно знать и понимать, каким образом осуществляются переходы между агрегатными состояниями веществ. Схему таких переходов изобразим на рисунке 2.

Рисунок. 2.
1 – плавление;
2 – отвердевание (кристаллизация);
3 – парообразование: испарение или кипение;
|
|
|
4 – конденсация;
5 – сублимация (возгонка) – переход из твердого состояния в газообразное, минуя жидкое;
6 – десублимация – переход из газообразного состояния в твердое, минуя жидкое.
2. Плавление и отвердевание
Плавление – процесс перехода из твердого состояния в жидкое. Этот процесс происходит при постоянной температуре.
Температура, при которой происходит плавление вещества, называется температурой плавления и является измеренной величиной для многих твердых веществ, а потому табличной величиной. Например, температура плавления льда равна 0oC, а температура плавления золота 1100oC.
Обратный плавлению процесс – процесс кристаллизации.
Если описанные процессы рассматривать с точки зрения внутренней энергии тела, то при плавлении вся полученная телом энергия расходуется на разрушение кристаллической решетки и ослабление межмолекулярных связей, таким образом, энергия расходуется не на изменение температуры, а на изменение структуры вещества и взаимодействия его частиц. В процессе же кристаллизации обмен энергиями происходит в обратном направлении: тело отдает тепло окружающей среде, а его внутренняя энергия уменьшается, что приводит к уменьшению подвижности частиц, увеличению взаимодействия между ними и отвердеванию тела.
График плавления и кристаллизации
Полезно уметь графически изобразить процессы плавления и кристаллизации вещества на графике (рис. 3).

Рисунок.3.График плавления и кристаллизации льда
Удельная теплота плавления– количество теплоты, которое необходимо сообщить 1 кг вещества, нагретому до температуры плавления, чтобы перевести его из твёрдого состояния в жидкое.
|
|
|
Такая же величина выделяется и при кристаллизации 1 кг вещества.
Обозначается удельная теплота плавления  (греческая буква, читается как «лямбда» или «ламбда»).
(греческая буква, читается как «лямбда» или «ламбда»).
Единицы измерения:
 .
.
В данном случае в размерности отсутствует температура, так как при плавлении (кристаллизации) температура не меняется.
Количество теплоты, необходимое для плавления вещества
Для вычисления количества теплоты, необходимого для плавления вещества, используется формула:
 , где:
, где:
 – количество теплоты (Дж);
– количество теплоты (Дж);
 – удельная теплота плавления, которая ищется по таблице;
– удельная теплота плавления, которая ищется по таблице;
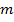 – масса вещества.
– масса вещества.
Когда тело кристаллизуется,  пишется со знаком «-», так как тепло выделяется.
пишется со знаком «-», так как тепло выделяется.
4. Испарение и конденсация
Молекулы жидкости движутся беспорядочно. Чем выше температура жидкости, тем больше кинетическая энергия молекул. Среднее значение кинетической энергии молекул при заданной температуре имеет определённое значение. Но у каждой молекулы кинетическая энергия в данный момент времени может оказаться как меньше, так и больше средней. В какой-то момент времени кинетическая энергия отдельных молекул может стать настолько большой, что они окажутся способными вылететь из жидкости, преодолев силы притяжения остальных молекул.
Процесс превращения жидкости в пар называется испарением.
При этом процессе число молекул, покидающих жидкость за определённый промежуток времени, больше числа молекул, возвращающихся в неё.
Процесс превращения жидкости в пар называется испарением.
Если поток воздуха над сосудом уносит с собой образовавшиеся пары жидкости, то жидкость испаряется быстрее, так как у молекулы пара уменьшается возможность вновь вернуться в жидкость. Чем выше температура жидкости, тем большее число молекул имеет достаточную для вылета из жидкости кинетическую энергию, тем быстрее идёт испарение.
При испарении жидкость покидают более быстрые молекулы, поэтому средняя кинетическая энергия молекул жидкости уменьшается.
|
|
|
Процесс испарения происходит со свободной поверхности жидкости. Если лишить жидкость возможности испаряться, то охлаждение её будет происходить гораздо медленнее.
Вылетевшая молекула принимает участие в беспорядочном тепловом движении газа. Беспорядочно двигаясь, она может навсегда удалиться от поверхности жидкости, находящейся в открытом сосуде, но может и вернуться снова в жидкость.
Процесс превращения пара в жидкость называется конденсацией.
При этом процессе число молекул, возвращающихся в жидкость за определённый промежуток времени, больше числа молекул, покидающих её.
По мере увеличения температуры жидкости интенсивность испарения увеличивается. Наконец, жидкость начинает кипеть. При кипении по всему объёму жидкости образуются быстро растущие пузырьки пара, которые вКипение — это процесс парообразования, происходящий по всему объёму сплывают на поверхность.
Температура кипения жидкости остаётся постоянной. Это происходит потому, что вся подводимая к жидкости энергия расходуется на превращение её в пар.
В жидкости всегда присутствуют растворённые газы, выделяющиеся на дне и стенках сосуда, а также на взвешенных в жидкости пылинках, которые являются центрами парообразования. Пары жидкости, находящиеся внутри пузырьков, являются насыщенными. С увеличением температуры давление насыщенных паров возрастает и пузырьки увеличиваются в размерах. Под действием выталкивающей силы они всплывают вверх. Если верхние слои жидкости имеют более низкую температуру, то в этих слоях происходит конденсация пара в пузырьках. Давление стремительно падает, и пузырьки захлопываются. Захлопывание происходит настолько быстро, что стенки пузырька, сталкиваясь, производят нечто вроде взрыва. Множество таких микровзрывов создаёт характерный шум. Когда жидкость достаточно прогреется, пузырьки перестанут захлопываться и всплывут на поверхность. Жидкость закипит.
Зависимость давления насыщенного пара от температуры объясняет, почему температура кипения жидкости зависит от давления на её поверхность. Пузырёк пара может расти, когда давление насыщенного пара внутри его немного превосходит давление в жидкости, которое складывается из давления воздуха на поверхность жидкости (внешнее давление) и гидростатического давления столба жидкости.
|
|
|
Испарение жидкости происходит и при температурах, меньших температуры кипения, но только с поверхности жидкости, при кипении же образование пара происходит по всему объёму жидкости.
Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается и становится чуть больше давления в жидкости.
Чем больше внешнее давление, тем выше температура кипения. (рис.4)
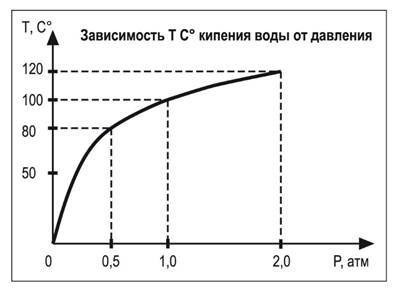

Рисунок.4
Так, в паровом котле при давлении, достигающем 1,6 • 106 Па, вода не кипит и при температуре 200 °С. В медицинских учреждениях в герметически закрытых сосудах — автоклавах (рис. 11.3) кипение воды также происходит при повышенном давлении. Поэтому температура кипения жидкости значительно выше 100 °С. Автоклавы применяют, например, для стерилизации хирургических инструментов, ускорения приготовления пищи (скороварка), консервации пищи, проведения химических реакций.
Удельная теплота парообразования оказывается очень важной характеристикой в современных технологиях производства металлов. Оказывается, что, например, при плавлении и испарении железа с его последующей конденсацией и затвердеванием образуется кристаллическая решетка с такой структурой, которая обеспечивает более высокую прочность, чем исходный образец.
Обозначение:  удельная теплота парообразования и конденсации (иногда обозначается
удельная теплота парообразования и конденсации (иногда обозначается  ).
).
Единица измерения:  .
.
Удельная теплота парообразования веществ определяется с помощью экспериментов в лабораторных условиях, и ее значения для основных веществ занесены в соответствующую таблицу.
| Вещество | 
|
| Вода | 
|
| Спирт | 
|
| Ртуть | 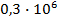
|
| Воздух (жидкий) | 
|
Если известно, что вещество находится при температуре кипения, то для вычисления количества теплоты, необходимого для превращения его в газообразное состояние используют следующую формулу:

Обозначения:
 количество теплоты парообразования, Дж;
количество теплоты парообразования, Дж;
 удельная теплота парообразования и конденсации,
удельная теплота парообразования и конденсации,  ;
;
 масса вещества, кг.
масса вещества, кг.
В случае рассмотрения процесса конденсации вещества формула, описывающая количество теплоты, остается такой же, но берется со знаком минус, что подчеркивает выделение тепла в процессе конденсации, в отличие от выделения тепла в процессе кипения, однако, зачастую этот минус не учитывается, если находится модуль количества теплоты.
|
|
|
Контрольные вопросы
- Как называется процесс перехода из кристаллического состояния в жидкое?
- Как называется переход обратный плавлению?
- Как называется процесс перехода из жидкого состояния в газообразное?
- Как называется переход из газообразного состояния в жидкое?
- Что обозначают буквы Q и знаки + и -?
- Какие переходы происходят с поглощением энергии?
- Какие переходы происходят с выделением энергии?
- С изменением какого вида внутренней энергии связано выделение или поглощение энергии при переходах из одного в другое агрегатное состояние?
- Почему температура кипения возрастает с увеличением давления?
Литература
1. Физика. 10 класс: учеб. для общеобразовательных организаций: базовый уровень/Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский; под ред. Н.А.Парфентьевой,-М.Просвещение, 2016 г. С.230-231.
|
|
|


