 |
Взаимодействие неаллельных генов
|
|
|
|
Ограниченность закона независимого наследования.
Необходимо отметить, что все эти расчеты, правомочны при одном важном условии: гены должны находиться в негомологичных хромосомах. Однако известно, что число хромосом для каждого вида организмов является относительно небольшим и постоянным. Следовательно, возможно одновременное независимое наследование лишь стольких генов, сколько пар гомологичных хромосом имеется у организмов данного вида.
Например, для гороха, имеющего 7 пар хромосом (n = 7), у гибрида возможно независимое сочетание не более семи одновременно взятых в скрещивание пар признаков. При этом в потомстве гибридного растения гороха возможно появление 27 различных фенотипических и 37 генотипических классов. Общее число возможных сочетаний гамет составит 47.
У классического для генетических исследований объекта плодовой мушки дрозофилы (Drosophila melanogaster) по независимо наследующимся парам признаков возможно только тетрагибридное скрещивание, так как у нее 4 пары хромосом.
Закономерности сцепленного наследования генов были изучены Т.Х.Морганом и его учениками в начале 20-х годов XX в. Объектом их исследований являлась именно плодовая мушка дрозофила (срок ее жизни невелик, и за год можно получить несколько десятков поколений, ее кариотип составляют всего четыре пары хромосом).
Закон Моргана: гены, локализованные в одной хромосоме, наследуются преимущественно вместе. Гены, лежащие в одной хромосоме называются сцепленными. Все гены одной хромосомы называются группой сцепления.
Очевидно, что если в скрещивании будет учитываться большее число генов, чем имеющееся у данного организма число пар гомологичных хромосом, то третий закон Менделя не осуществится. В этом случае вступят в действие другие закономерности.
|
|
|
На первый взгляд это ограничение закона независимого сочетания признаков может создать впечатление ограниченности наследственной изменчивости в силу небольшого числа возможных комбинаций гамет. Однако это не так. Рассмотрим для примера возможный размах комбинативной изменчивости, возникающей в силу свободной комбинации гамет у человека. Допустим, что в каждой из 23 пар хромосом человека имеется только по одной паре аллелей. При этом число различных типов гамет выразится величиной 8 388 608, а их возможных комбинаций — 70 368 744 177 664.
Кроме того, сцепление может нарушаться и входе мейоза при кроссинговере. Кроссинговер приводит к генетической рекомбинации. Чем дальше друг от друга расположены гены, тем чаще между ними происходит кроссинговер. На этом явлении основано построение генетических карт — определение последовательности расположения генов в хромосоме и примерного расстояния между ними.
Таким образом, расщепление при полигибридном скрещивании осуществляется по тем же законам, что и при моногибридного скрещивания. Однако, к условиям, при которых соблюдается расщепление по Менделю в случае моногибридного скрещивания, необходимо добавить еще 2: 1) нахождение учитываемых генов в негомологичных хромосомах; 2) равновероятное образование всех сортов гамет на основе случайного расхождения негомологичных хромосом в мейозе.
ТИПЫ ВЗАИМОДЕЙСТВИЯ ГЕНОВ
Ген как единица наследственности, детерминирующая признаки организма, имеет определенные функциональные свойства. Из изложенного ранее ясно, что в своем действии ген дискретен; он определяет присутствие или отсутствие отдельной биохимической реакции, от которой зависит развитие или подавление определенного признака организма. Очевидно, если несколько генов определяют какое-либо одно свойство (окраска глаз человека, длина колоса пшеницы и т.п.), они должны взаимодействовать между собой. Генетический анализ позволяет на основе изучения расщепления по фенотипу судить о характере действия и взаимодействия генов.
|
|
|
Переходя к рассмотрению указанных особенностей действия генов, необходимо условиться о системе их обозначения. До сих пор мы пользовались любыми большей частью начальными буквами латинского алфавита. Однако для организмов разных видов принята различная номенклатура генов. Для обозначения генов, как правило, используются одна или две первые буквы названия признака, определяемого данным геном. Чаще всего эти названия даются на английском или латинском языке. Например, рецессивную аллель гена, определяющую карликовость у кур (Gallus gallus) обозначают dw (dwarf - карлик), а его доминантную аллель, определяющую нормальные размеры тела - Dw, рецессивная аллель гена желтой окраски эндосперма у кукурузы обозначена у (yellow - желтый), его доминантная аллель -Y. Иногда доминантную аллель обозначают значком «+», например dw+, y+.
Взаимодействовать могут как аллельные гены, так и неаллельные.
Различают 3 формы взаимодействия аллельных генов: полное доминирование, неполное доминирование, кодоминирование.
Полное доминирование — явление, когда доминантный ген полностью подавляет работу рецессивного гена, в результате чего развивается доминантный признак.
Неполное доминирование — явление, когда доминантный ген не полностью подавляет работу рецессивного гена, в результате чего развивается промежуточный признак.
Кодоминирование (независимое проявление) — явление, когда в формировании признака у гетерозиготного организма участвуют обе аллели. По принципу кодоминирования у человека наследуется группа крови.
Группы крови - разделение индивидуумов одного и того же биологического вида по особенностям крови, в основе которых лежат различия в строении эритроцитарных белков — гликопротеидов, обусловленные разными типами биосинтеза. У людей впервые три Г. к. были обнаружены в 1900 австр. врачом К. Ландштейнером. Вскоре была выделена и четвёртая. Учение об основных группах крови было сформулировано чешским. учёным Я. Янским (1907), применившим цифровое обозначение различных групп. В 1928 гигиенической комиссией Лиги Наций утверждена буквенная номенклатура групп крови, используемая во всём мире (система AB0).
|
|
|
Ген, определяющий группу крови у человека I, представлен серией множественных аллелей: IА, IВ, I0. При этом гены, обусловливающие группы крови IА и IВ являются кодоминантными по отношению друг к другу и оба доминантны по отношению к гену, определяющему группу крови I0.
В результате у человека выделяется 6 генотипов групп крови и 4 физиологические группы крови.
| I группа | I0I0 | гомозигота | |
| II группа | А | IАIА | гомозигота |
| IАI0 | гетерозигота | ||
| III группа | В | IВIВ | гомозигота |
| IВI0 | гетерозигота | ||
| IV группа | АВ | IАIВ | гетерозигота |
Принадлежность к той или иной группе крови, определяют не только факторы А и В (антигены, или агглютиногены), содержащиеся в эритроцитах, но и факторы α и β (антитела, или агглютинины), обнаруживаемые в плазме крови. У одной группы людей эритроциты не содержат агглютиногенов А и В, а в сыворотке обнаруживаются агглютинины α и β. Учитывая агглютинины, I группа крови обозначается, как 0αβ. У людей с кровью II группы в эритроцитах содержится агглютиноген А, а в плазме агглютинин β; буквенное обозначение Аβ. В эритроцитах III группы крови содержится агглютиноген В, а в плазме агглютинин α; буквенное обозначение Вα. IV группа крови, содержащая в эритроцитах агглютиногены А и В, агглютининов в плазме не содержит, её обозначение AB0. Групповые антигены А и В содержатся также в лейкоцитах, тромбоцитах, сперматозоидах, в нормальных и опухолевых тканях, в слюне, в желудочном соке, жёлчи, в околоплодных водах.
При взаимодействии одноимённых агглютиногенов и агглютининов (например, А+α, В+β) происходит склеивание эритроцитов гемагглютинация с их последующим гемолизом. Такое взаимодействие обусловливает групповую несовместимость; оно возможно только при переливании иногруппной крови.
|
|
|
Кроме того, кровь разных людей может отличаться резус-фактором. Кровь может иметь положительный резус-фактор (Rh+) или отрицательный резус-фактор (Rh-). Резус-фактор крови определяет ген R. R+ дает информацию о выработке белка (резус положительный белок), а ген R- — не дает. Первый ген доминирует над вторым. Если Rh+ кровь перелить человеку с Rh- кровью, то у него образуются специфические агглютинины, и повторное введение такой крови вызовет агглютинацию. Когда у Rh- женщины развивается плод, унаследовавший у отца положительный резус, может возникнуть резус-конфликт.
Кровь всех групп крови качественно равноценна, но групповые различия должны обязательно учитываться при переливании крови и пересадках тканей и органов. Совместимость донора и реципиента по группам крови - необходимое условие успешной трансплантации.
Определение группы крови производится смешиванием (на предметном стекле) стандартных сывороток с кровью, подлежащей исследованию. Испытуемая кровь относится к той группе, с сывороткой которой не произошла агглютинация. Если агглютинация произошла во всех четырёх каплях, то испытуемая кровь AB (IV) группы (рис. 1).

Рисунок 1. Определение групп крови при помощи стандартных сывороток.
Каждому человеку можно переливать кровь одноимённой или 0 (I) группы. Кровь 0 (I) группы можно переливать реципиентам всех групп, т. к. в группе 0 (I) нет антигенов-агглютиногенов и потому агглютинины реципиента ни с чем не соединяются и реакции агглютинации не происходит. Доноров 0 (I) группы называют «универсальными». Людям с кровью AB (IV) группы возможно переливание крови любой группы.
Наиболее полно изучены группы крови свиней, крупного рогатого скота, лошадей, овец; исследованы также группы крови у кур, собак, кошек, кроликов и некоторых др. видов. Антигены и антигенные системы групп крови животных многочисленны. Описано не менее 12 систем эритроцитарных антигенов крупного рогатого скота и более 100 составляющих их факторов. Разнообразные сочетания антигенов создают десятки и сотни разновидностей групп крови у животных одного вида. При длительной селекции в пределах одной породы разнообразие групп крови уменьшается. Определение частоты встречаемости различных эритроцитарных антигенов служит одной из характеристик породы.
Определение групп крови применяют в животноводческой практике для линейного разведения, определения отцовства, установления структуры породы, анализа генеалогических и заводских линий, проверки породы при импорте и экспорте. Однако кровь животных, независимо от её групповой принадлежности, абсолютно не совместима с кровью человека.
|
|
|
ВЗАИМОДЕЙСТВИЕ НЕАЛЛЕЛЬНЫХ ГЕНОВ
Если несколько генов определяют одно свойство организма (окраску цветка, длину шерсти и др.), то они взаимодействуют друг с другом. При этом в потомстве дигетерозиготы может наблюдаться необычное расщепление - 9:3:4; 9:7; 9:6:1; 13:3; 12:3:1; 15:1. Генетический анализ показывает, что необычные расщепления по фенотипу в F2 представляют видоизменение общей менделевской формулы 9:3:3:1. Известны случаи взаимодействия трех и большего числа генов с изменением обычных формул расщепления.
Наиболее часто встречаются 3 формы взаимодействия неаллельных генов: кооперация, комплементарность, эпистаз и полимерия.
Комплементарность — явление, когда признак развивается только при взаимном действии двух доминантных неаллельных генов, каждый из которых в отдельности не вызывает развитие признака.
Эпистаз — явление, когда один ген (как доминантный, так и рецессивный) подавляет действие другого (неаллельного) гена (как доминантного, так и рецессивного). Ген-подавитель (супрессор) может быть доминантным (доминантный эпистаз) или рецессивным (рецессивный эпистаз).
Полимерия — явление, когда несколько неаллельных доминантных генов отвечают за сходное воздействие на развитие одного и того же признака. Чем больше таких генов присутствуют в генотипе, тем ярче проявляется признак. Явление полимерии наблюдается при наследовании количественных признаков (цвет кожи, вес тела, удойность коров).
В противоположность полимерии наблюдается такое явление, как плейотропия — множественное действие гена, когда один ген отвечает за развитие нескольких признаков.
Комплементарность. Комплементарными или дополнительными называют такие доминантные гены, которые при совместном нахождении в генотипе (А-В-) обусловливают развитие нового признака по сравнению с действием каждого гена, в отдельности (A-bb или ааВ-).
Расщепление 9:3:3:1. Так, у дрозофилы встречается коричневая и ярко-красная окраска глаз. Обе эти окраски рецессивны к красной окраске (дикий тип). При скрещивании мух с коричневыми и ярко-красными глазами гибриды F1 оказываются красноглазыми, а в F2 наблюдается расщепление на 4 фенотипических класса в отношении 9/16 красные: 3/16- ярко-красные: 3/16 коричневые и 1/16 белые (рис. 2).
Отличие исходных форм по одной паре признаков могло бы свидетельствовать о моногенных различиях между ними. Однако в F1 вместо доминирования одного из признаков появляется новое качество - красная окраска, а в F2 осуществляется дигибридное расщепление с тем лишь отличием от менделевского, что оно идет по одному, а не по двум свойствам (только окраска глаз). При этом здесь проявляется еще один новый признак - белый цвет глаз. Таким образом, генетический анализ свидетельствует о том, что в этом скрещивании участвуют не одна, а две пары генов.
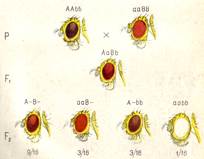
Рисунок 2. Наследование окраски глаз у дрозофилы (комплементарность). Окраска глаз: а —ярко-красная; в —коричневая.
Мы можем сделать вывод, что гены А и В вместе определяют красную окраску глаз дикого типа, а - ярко-красную, в - коричневую. Тогда генотип мух с коричневыми глазами можно обозначить AAbb, с ярко-красными — ааВВ, генотип красноглазых гибридов — АаВb и белоглазых мух aabb. Фенотипические радикалы полученных в F2 классов могут быть представлены как 9 А-В-, 3 ааВ-, 3 A-bb, 1 aabb.
Биохимический анализ глазных пигментов показал, что красная окраска глаз обеспечивается тремя видами пигментов: ярко-красным, коричневым и желтым.
Рецессивный ген а блокирует образование коричневого пигмента, вследствие чего развиваются ярко-красные глаза, другой рецессивный ген — b блокирует одновременно образование красного и желтого пигментов, и поэтому образуется только коричневый пигмент. В F1 объединяются доминантные аллели этих генов, и поэтому синтезируются все пигменты, дающие в совокупности красную окраску глаз. Белоглазые мухи, появляющиеся в F2, являются результатом одновременного блокирования синтеза всех трех пигментов.
Аналогичное наследование встречается и у растений. Например, окраска плодов у томатов (Lycopersicon esculeritum) обусловливается каротиновыми пигментами, имеющими огромное значение в синтезе витаминов. Генетический анализ показывает, что красная окраска плодов определяется взаимодействием комплементарных доминантных генов R и Т, оранжевые плоды образуются на растениях с генотипом R-tt, желтые — с генотипом rrТ-, промежуточные желто-оранжевые — rrtt. Здесь также расщепление в F2 соответствует генетической формуле дигибридного скрещивания 9:3:3: 1.
Таким образом, в случае, когда каждый из двух рецессивных неаллеальных генов проявляет самостоятельный фенотипический эффект, расщепление в F2 по фенотипу соответствует менделевскому отношению 9:3:3:1, так как каждый из четырех классов имеет свой особый фенотип.
Расщепление 9:7. Если же рецессивные аллели дают одинаковый фенотипический эффект, характер расщепления меняется. Например, у белого клевера (Trifolium repens) имеются формы с высоким и низким содержанием цианида. При скрещивании их в F1 доминирует первое свойство, а в F2 наблюдается расщепление, близкое к отношению 3:1. Следовательно, эти альтернативные признаки определяются одной парой аллелей. Но иногда при скрещивании двух растений клевера с низким содержанием цианида гибриды F1 имеют много цианида, а в F2 расщепление оказывается близким к отношению 9/16 с высоким содержанием цианида и 7/16 — с низким.
Чтобы выяснить, укладывается ли это расщепление в схему дигибридного менделевского расщепления, представим, что у каждой исходной расы клевера имеется в гомозиготном состоянии лишь по одной из доминантных аллелей (LLhh или llHH), которые при взаимодействии определяют развитие цианида. Поскольку у гибрида первого поколения F1: присутствуют доминантные аллели обоих генов L-H-, в его листьях будет много цианида. В F2 : происходит расщепление в отношении 9/16 L-H-: 3/16 L-hh: 3/16 llН-: 1/16 llhh. Каждый из доминантных генов самостоятельно не может обусловить выработку большого количества цианида, поэтому у растений с генотипами L-hh и llН — мало цианида, и в F2 наблюдается расщепление по фенотипу в отношении 9: 7.
Генетический анализ нашел подтверждение в биохимическом анализе. Оказалось, что цианид в листьях клевера образуется из глюкозида линамарина под действием фермента линамаразы. Химический анализ листьев клевера разных генотипов проливает свет на характер взаимодействия этих двух пар генов. Экстракт растений L-H- в норме содержит цианид. Дли того чтобы цианид образовался в листьях растений L-hh, необходимо добавить линамаразу, а в 11Н- линамарин. В растениях же llhh при добавлении любого компонента цианид не образуется. Следовательно, мы можем сделать вывод, что ген L обеспечивает образование линамарина, а ген H вырабатывает фермент линамаразу, превращающий линамарин в цианид. Переход гена L в рецессивное состояние l прерывает реакцию образования линамарина, а ген h блокирует образование фермента. Таким образом, в данном случае совместный генетический и биохимический анализы дают представление о механизме взаимодействия генов (табл. 2).
Таблица 2
Образование цианида экстрактами растений клевера разных генотипов
| Что исследуется Генотип | Только экстракт | Экстракт + Линамарин | Экстракт + линамараза |
| L-H- L-hh 11Н llhh | + | + + | + + |
Подобный тип взаимодействия генов, дающий в F2 расщепление 9:7, найден у многих растений, животных и человека. Так, например, наследуется пурпурная и белая окраска цветка у душистого горошка (Lathyrus odoratus), желтая и белая окраска коконов у шелкопряда, нормальный слух и глухота у человека и т. п.
Расщепление в F2 по фенотипу 9: 7 есть видоизменение расщепления 9:3:3:1, определяемое тем, что и доминантные и рецессивные гены не имеют самостоятельного фенотипического проявления.
Расщепление 9:3:4. До сих пор были рассмотрены примеры комплементарного взаимодействия, при котором каждый из доминантных генов в отдельности не обладал способностью вызвать развитие признака. Известны, однако, случаи, когда оба доминантных комплементарных гена характеризуются самостоятельным проявлением. В соответствии с этим меняется и характер расщепления в F2. Рассмотрим наследование трех типов окраски шерсти у кроликов (Lepus cuninculus) — дикой рыжевато-серой (агути), черной и белой. Окраска дикого типа зависит от наличия гена, распределяющего пигмент по длине волоса. Каждая шерстинка у кроликов агути имеет посередине желтое кольцо, а в основании и на конце — черный пигмент. Такое зонарное распределение пигментов и создает окраску агути, свойственную всем диким грызунам.
У черных кроликов шерстинки по всей длине окрашены равномерно в черный цвет. Белые кролики с красной радужной оболочкой глаз (альбиносы) вовсе лишены пигмента.
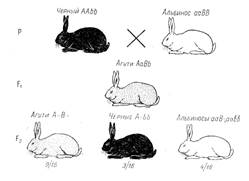
Рисунок 3. Наследование окраски шерсти у кроликов (комплементарность). Окрас шерсти: А – окрашенность; а - альбинизм; В - зонарная (агути); b - черная.
При скрещивании черных кроликов с белыми все гибриды оказываются агути, а в F2 наблюдается расщепление в отношении 9/16 агути: 3/16 черных: 4/16 белых (рис. 3). Если провести анализ этого скрещивания в начале по наличию и отсутствию пигмента, не обращая внимания на его качество, то можно прийти к выводу, что окрашенность доминирует над неокрашенностью, а в F2 наблюдается расщепление на 12 окрашенных (9 + 3) и 4 белых, т. е. 3: 1. В то же время в F2 осуществляется расщепление на 9 агути и 3 черных (3: 1). Гены можно обозначить следующим образом: А - наличие окраски, а - отсутствие ее, В - окраска агути, b - черная. Тогда исходные кролики-альбиносы являются, очевидно, гомозиготными по рецессивному гену отсутствия окраски и доминантному гену агути (ааВВ), а черные кролики - гомозиготными по доминантному гену наличия окраски и рецессивному гену черной окраски (ААbb). У гибридов F1 (АаВb) вследствие взаимодействия доминантных аллелей обоих генов развивается окраска типа агути. Такая же окраска характерна и для 9/16 особей в F2 с генотипом А-В-. Черными в F2 оказываются кролики, имеющие генотип A-bb, а белыми — все остальные (ааВ- и aabb) в силу отсутствия у них гена А, определяющего образование пигмента. Ген В в отсутствии гена А не проявляется.
Подобный тип наследования широко распространен в природе. Например, у ржи (Secale cereale) скрещивание белозерных растений с желтозерными дает в F1 только зеленую окраску зерна, а в F2 расщепление в отношении 9 зеленых: 3 желтых: 4 белых [9:3: (3+1)]. Аналогично наследуется белая, красная и чалая масти у крупного рогатого скота и т. п.
Расщепление 9:6:1. В ряде случаев комплементарные гены, способные к самостоятельному проявлению, при отсутствии дополнительного гена могут давать каждый в отдельности сходный фенотипический эффект. Характер расщепления дигетерозиготы в F2 при этом также изменяется. Так, у тыквы (Cucurbita pepo) имеются сорта с разной формой плода: сферической, дисковидной и удлиненной (рис. 4). Сферическая форма плода является рецессивной но отношению к дисковидной. От скрещивания растений с плодами сферической формы, но имеющих разное происхождение, получаются гибридные растения, дающие дисковидные плоды. В потомстве у этих растений в F2 появляются три фенотипических класса в отношении: 9/16 с дисковидными плодами, 6/16 — со сферическими и 1/16 — с удлиненными. Нетрудно понять, что и здесь имеет место взаимодействие двух генов, определяющих форму плода. Каждый из доминантных комплементарных генов обусловливает развитие плодов сферической формы, а их взаимодействие приводит к образованию дисковидных плодов. Взаимодействие рецессивных аллелей этих генов определяет развитие плодов удлиненной формы. Таким образом, и здесь видоизменяется обычное дигибридное расщепление [9: (3 + 3):1].
Подобный тип взаимодействия наблюдается в наследовании окраски щетины у свиней (Sus scrofa). При скрещивании двух разных пород с песочной окраской в F1 появляется красная окраска, а в F2 расщепление на 9 красных, 6 песочных и 1 белую.
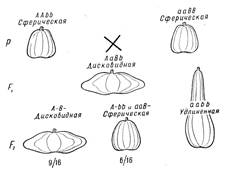 1/16
1/16
Рисунок 4. Наследование формы плода у тыквы (комплементарность).
Рассматривая примеры комплементарного действия генов, можно убедиться, что оно иногда приводит к развитию у гибридов признаков, несвойственных исходным формам, т. е. к новообразованиям. Зачастую эти «новообразования» являются признаками, свойственными диким предкам данных видов, например окраска агути у кроликов и т. п. У диких предков домашних животных и растений доминантные гены комплементарного действия поддерживались естественным отбором вместе в одном генотипе. При одомашнивании с помощью скрещиваний и искусственного отбора комплементарные гены разобщились. Генотип АаВb разлагался селекционерами на генотипы AAbb и ааВВ. Поэтому при скрещивании и наблюдается иногда как бы возврат к признакам диких предков.
Эпистаз. При доминировании действие одной аллели подавляются другой аллелью этого же гена: А>а, В>b и т. д. Но существует взаимодействие, при котором один ген подавляет действие другого, например А>В или B>A, а>В или b>А и т. д.
Такое явление называется эпистазом. Гены, подавляющие действие других генов, называются супрессорами или ингибиторами. Они могут быть как доминантными, так и рецессивными. Гены-супрессоры известны у животных, растений и микроорганизмов. Обычно они обозначаются I или S.
Эпистаз принято делить на два типа: доминантный и рецессивный.
Под доминантным эпистазом понимают подавление одним доминантным геном действия другого гена.
Расщепление 13:3. Из многих примеров доминантного эпистаза приведем лишь некоторые. Так, у льна (Linura usitatissimum) наряду с формами, имеющими нормальные лепестки, встречаются растения с гофрированными лепестками. При скрещивании двух форм с нормальными лепестками, имеющих разное происхождение, в F1 все гибриды имеют нормальные лепестки, а в F2 получается расщепление: 13/16 растений с нормальными лепестками и 3/16 - с гофрированными. Характер расщепления свидетельствует о том, что форма лепестков определяется двумя парами генов. В таком случае одно из исходных растений должно нести в скрытом состоянии ген гофрированности лепестков, действие которого подавлено ингибитором. Следовательно, у растений этого генотипа нормальная форма лепестков определяется не особыми генами (нормальной формы лепестков), а геном - подавителем гофрированности.
Обозначим ген гофрированности лепестков - А, нормальной формы - а (это основные гены формы лепестков), ингибитор гофрированности - I, ген отсутствия подавления - i. Тогда исходные формы с нормальными лепестками будут иметь генотипы IIАА и iiaа, гибриды F1 IiАа — также нормальные, а расщепление в F2 13/16 нормальных: 3/16 гофрированных можно представить как 9 (I-A-)+3 (I-аа) +1 (iiaa) = 13 нормальных и 3 iiA - гофрированных. Таким образом, подавление действия доминантного гена гофрированности лепестков доминантной аллелью другого гена (подавителя) обусловливает в F2 расщепление по фенотипу в отношении 13:3 [(9 + 3+1): 3].
Этот тип взаимодействия широко распространен в природе и наблюдается в наследовании окрашенности и неокрашенности зерен у кукурузы и оперения у кур и т. п. На рисунке 5 изображено наследование окраски луковицы у лука Allium сера.
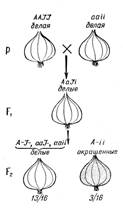
Рисунок 5. Наследование окраски луковицы у Allium сера (эпистаз): А - наличие окраски; а - отсутствие окраски; I - подавитель окраски; i - окраска не подавляется.
Расщепление 12:3:1. Доминантный эпистаз может давать и другое расщепление в F2 по фенотипу, а именно 12: 3: 1 [(9 + 3): 3: 1]. В этом случае, в отличие от предыдущего, форма, гомозиготная по обоим рецессивным генам, имеет специфический фенотип.
Например, некоторые собаки (Canis familiaris) с белой окраской шерсти при скрещивании с собаками, имеющими коричневую окраску, дают в F1 щенков с белой окраской, а в F2 расщепление на 12/16 белых, 3/16 черных и 1/16 коричневых (рис. 6). Если проанализировать это скрещивание отдельно по свойству окрашенности-неокрашенности и черно-коричневой окраске, то можно убедиться, что отсутствие окраски в F1 доминирует над ее наличием, а в F2 наблюдается расщепление 12:4, или 3:1. Расщепление на 3 черных и 1 коричневую свидетельствует о том, что черная окраска определяется доминантным геном, а коричневая - рецессивным. Теперь можно обозначить ингибитор окраски - I, его отсутствие - i, черную окраску - А, коричневую - а. Тогда легко представить генотипы исходных форм и гибридов. Подобный тип эпистаза встречается в наследовании окраски плодов у тыквы, окраски шерсти у овец (Ovis aries) и во многих других случаях. Таким образом, гены-подавители обычно не определяют сами какой-либо качественной реакции в развитии данного признака, а лишь подавляют действие других генов. Но в некоторых случаях это не так. Например, у хлопка (Gossypium) по окраске волокон в F2 наблюдается расщепление на 12 коричневых: 3 зеленых: 1 белую. Однако анализ коричневых волокон в ультрафиолетовых лучах позволяет выделить два типа коробочек: 3, имеющих волокна только с коричневым пигментом, и 9 — с коричневым и зеленым. У растений последнего типа зеленая окраска оптически не видна, так как коричневый пигмент ее как бы подавляет, т. е. является ингибитором.

Рисунок 6. Наследование окраски шерсти у собак (эпистаз): А—черная окраска; а — коричневая; I — подавляет окраску; i — не подавляет.
Под рецессивным эпистазом понимают такой тип взаимодействия, когда рецессивная аллель одного гена, будучи в гомозиготном состоянии, не дает возможности проявиться доминантной или рецессивной аллели другого гена: аa>B- или aa>bb.
Расщепление 9:3:4 приводилось как пример комплементарного взаимодействия генов. Но эти же случаи можно рассматривать и как рецессивный эпистаз.
При скрещивании черных кроликов (AAbb) с белыми (ааВВ) все гибриды (АаВb) имеют окраску типа агути, а в F2 9/16 крольчат оказываются агути (А-В-), 3/16 черных (A-bb) и 4/16 белых (ааВ- и aabb). Эти результаты можно объяснить, предположив, что имеет место рецессивный эпистаз типа аа>В- и aa>bb. При этом кролики генотипа ааВ- и aabb оказываются белыми потому, что ген а в гомозиготном состоянии, блокируя образование пигмента, препятствует тем самым проявлению гена — распределителя пигмента В и гена черной окраски b.
Кроме описанных случаев одинарного рецессивного эпитаза, существуют и такие, когда рецессивная аллель каждого гена в гомозиготном состоянии одновременно реципрокно подавляет действие доминантной аллели комплементарного гена, т. е. аа эпистатирует над В-, bb над А-. Такое взаимодействие двух рецессивных подавителей называют двойным рецессивным эпистазом. В дигибридном скрещивании расщепление по фенотипу — 9: 7, как и в случае комплементарного взаимодействия генов.
Следовательно, одно и то же расщепление можно трактовать как результат и комплементарного взаимодействия, и эпистаза. Один генетический анализ наследования при взаимодействии генов без знания биохимии и физиологии развития признака в онтогенезе не может раскрыть природы этого взаимодействия. Но без генетического анализа нельзя понять механизм наследственной детерминации развития этих признаков.
Полимерия. Рассмотренные до сих пор типы взаимодействия сенов относились к альтернативным, т. е. качественно различающимся, признакам.
Такие свойства организмов, как, например, темп роста и вес животного, длина стебля растения и т. п., нельзя разложить на четкие фенотипические классы; их необходимо измерять, взвешивать, подсчитывать, т.е. оценивать количественно. Подобные признаки обычно называют количественными или мерными признаками. Если расположить, например, овец одной породы в порядке возрастания их веса, то между самым мелким и крупным животными будет серия незаметных переходов, образующих непрерывный ряд.
Наследование таких признаков может происходить по-разному. При одном варианте, признак формируется под действием аллелей одного гена, который может быть представлен разным числом их в генотипе. Например, содержание витамина А в эндосперме зерна кукурузы зависит от количества доминантных аллелей гена у. Как известно, клетки эндосперма содержат три набора хромосом. Следовательно, путем скрещивания можно получить четыре различных по генотипу эндосперма кукурузы, содержащих разное количество доминантных и рецессивных аллелей у. Количество витамина А (в единицах активности) при разных дозах одного и того же гена оказывается следующим:
В эндосперме генотипа у у у... 0,05
»»» Y у у... 2,25
»»» Y Y у... 5,00
»»» Y У У... 7,50
Как видно из приведенных данных, действие одной дозы доминантного гена Y соответствует примерно 2,25 - 2,50 единиц активности витамина А. С увеличением дозы гена его действие суммируется, или кумулируется.
Такой тип действия гена называют кумулятивным или аддитивным, т. е. суммирующимся.
При другом варианте формирование количественного признака у организма, определяется взаимодействием многих доминантных генов, действующих на один и тот же признак или свойство. В этом случае количественные признаки, могут образовывать по своему проявлению непрерывный ряд. При этом, количественно варьирующий признак у разных особей одного и того же поколения будет определяться разным числом доминантных генов в генотипе. Так, при скрещивании рас пшениц (Triticum) с красными и белыми (неокрашенными) зернами шведский генетик Г. Нильсон-Эле в 1908 г. обнаружил в F2 обычное моногибридное расщепление в отношении 3:1.
Однако при скрещивании некоторых других линий пшениц, различающихся по таким же признакам, в F2 наблюдается расщепление в отношении 15/16 окрашенных: 1/16 белых. Окраска зерен из первой группы варьирует от темно- до бледно-красных (рис. 7).
Генетический анализ растений из семян F2 разных окрасок показал, что растения, выращенные из белых зерен и из зерен с наиболее темной (красной) окраской, в дальнейшем не дают расщепления. Из зерен с окраской промежуточного типа развились растения, давшие в последующих поколениях расщепление по окраске зерна. Анализ характера расщепления позволил установить, что в данном случае красную окраску зерен определяют доминантные аллели двух разных генов, а сочетание их рецессивных аллелей в гомозиготном состоянии определяет отсутствие окраски. Интенсивность окраски зерен зависит от числа доминантных генов в генотипе.

Рисунок 7. Наследование окраски зерна у пшеницы (полимерия)
Гены такого типа, одинаково влияющие на развитие одного признака, были названы генами с однозначным действием или полимерными. Такое же название получили и сами признаки. Поскольку эти гены однозначно влияют на один и тот же признак, было принято обозначать их одной латинской буквой с указанием номера разных генов: А1, А2, A3 и т. д. Этот тип взаимодействия генов получил название полимерии.
Следовательно, исходные родительские формы, давшие расщепление в F2: 15:1, имели генотипы А1А1А2А2 и а1а1а2а2. Гибрид F1: обладал генотипом Ala1A2a2, а в F2 появились зерна с разным числом доминантных генов. Наличие всех четырех доминантных аллелей A1A1A2A2 у 1/16 растений определяет самую интенсивную окраску зерна; 4/16 всех зерен имели три доминантных аллели (типа A1A1A2a2), 6/16 — две (типа A1a1A2a2), 4/16 — одну (типа A1a1a2a2), все эти генотипы определяли различные промежуточные окраски, переходные между интенсивно-красной и белой. Гомозиготной по обоим рецессивным генам (a1a1a2a2) являлась 1/16 всех зерен, и эти зерна оказались неокрашенными.
Нетрудно заметить, что частоты пяти перечисленных генотипических классов F2 распределяются в ряде: 1+4 + 6 + 4+1 = 16, который отображает изменчивость признака окраски зерна пшеницы в зависимости от числа доминантных аллелей в генотипе. Аналогичный тип наследования известен для некоторых видов окраски зерен кукурузы, колосковой чешуи у овса и т. п.
При накоплении доминантных полимерных генов их действие суммируется, т. е. они имеют кумулятивный эффект, поэтому взаимодействие такого типа называют кумулятивной полимерией.
Очевидно, что если у гибрида F1 число таких генов в гетерозиготном состоянии оказывается не два, а три А1а1А2a2А3а


