| Катионы
| Признак реакции
| Уравнение
|
| Катионы щелочных металлов:
Li+, Nа+, K+, Rb + Cs+
| Катионы щелочных металлов возможно провести только с сухими солями. Обнаружить их можно при внесении небольшого количества соли в пламя горелки.
Li+ — темно-розовый.Na+— желтый. K+ — фиолетовый. Rb+ — красный. Cs+— голубой.
| При сливании раствора соли лития с фосфатами образуется нерастворимый в воде, но растворимый в конц. азотной кислоте, фосфат лития: 3Li+ + PO43- → Li3PO4↓ Li3PO4 + 3HNO3 → 3LiNO3 + H3PO4
Катион K+ можно вывести гидротартрат -анионом HC4H4O6- — анионом винной кислоты: K+ + HC4H4O6- → KHC4H4O6↓
Катионы K+ и Rb+ можно выявить добавлением к растворам их солей кремнефтористой кислоты H2[SiF6] или ее солей — гексафторсиликатов: 2Me+ + [SiF6]2- → Me2[SiF6]↓ (Me: Rb)
Они же и Cs+ осаждаются из растворов при добавлении перхлорат- анионов: Me+ + ClO4- →MeClO4↓ (Me: K, Rb, Cs).
|
| Катионы щелочно - земельных металлов (Ca2+, Sr2+, Ba2+, Ra2+).
| Катионы щелочно- земельных металлов можно выявить двумя способами: в растворе и по окраске пламени. К щелочно-земельным относятся кальций, стронций, барий и радий. Бериллий и магний нельзя отнести к этой группе.
Окраска пламени: Ca2+ — кирпично-красный.Sr2+ — карминово-красный.Ba2+ — желтовато-зеленый. Ra2+ — темно-красный.
| Са2+:
Са2+ + СО32- = CaCO3↓: 2Н+ + СО32- - = H2O + CO2↑
Катионы Ba2+, Sr2+ и Ra2+ предпочитают выявлять сульфат- анионом с образованием сульфатов, нерастворимых в кислотах: Sr2+ + SO42- = SrSO4↓ Ba2+ + SO42- = BaSO4↓ Ra2+ + SO42- = RaSO4↓
|
| Рb 2+
| Качественная реакция на катион свинца — образование хлорида свинца (осадок белого цвета), либо образование иодида свинца (осадок ярко желтого цвета).
| Рb 2++ 2Сl- → РbCl2 ↓
Рb 2++ 2I-- → PbI2↓
|
| Аg+
| -белый творожистый ↓ АgCl
-желтовато-белый ↓ АgBr
---желтый ↓ АgI
- черный ↓ Ag2O
| Ag+ + Cl- = AgCl↓ Ag+ + Br- = AgBr↓ Ag+ + I- = АgI ↓ 2Ag+ + 2OH- = Ag2O↓ + H2O
|
| Аl3+ Cr3+ Zn2+
Sn2+
| Данные катионы объединены образованием нерастворимых оснований, легко переводимых в комплексные соединения. Групповой реагент — щелочь.
| Al3+ + 3OH- = Al(OH)3↓ + 3OH- = [Al(OH)6]3- Cr3+ + 3OH- = Cr(OH)3↓ + 3OH- = [Cr(OH)6]3- Zn2+ + 2OH- = Zn(OH)2↓ + 2OH- = [Zn(OH)4]2- Sn2+ + 2OH- = Sn(OH)2↓ + 2OH- = [Sn(OH)4]2-
Раствор, содержащий [Cr(OH)6]3- при добавлении хлорной или бромной воды в щелочной среде становится желтым из-за образования хромат-аниона CrO42-: 2 [Cr(OH)6]3- + 3Br2 + 4OH- = 2CrO42- + 6Br-+ 8H2O
|
| Fе2+
| 1.Fe(OH)2 — осадок зеленогоцвета. На воздухе становится бурымиз-за окисления.
2.Красная кровяная соль –гексацианоферрат калия (K3[Fe(CN)6]). Образуется осадок темно- синего цвета.
| Fe2+ + 2OH- = Fe(OH)2↓ 4Fe(OH)2 + O2 + 2H2O → 4 Fe(OH)3 ↓
2 К3[Fe(CN)6 ] +3 Fe SO4 = KFe[Fe(CN)6])↓ + 3K2SO4
|
| Fе3+
| 1.K4[Fe(CN)6] -желтая кровяная соль- образует темно-синий осадок берлинской лазури.
2.Гидроксиды щелочных металлов и NH4OH образуют гидроксид железа (III) красно-бурого цвета.
3.Роданид калия или аммония вызывает кроваво-красноеокрашивание раствора.
| 4K4[Fe(CN)6] + 4Fe3+ → 12К+ + 4 КFe [Fe (CN)6]↓
Fe3+ + 3OH- →Fe(OH)3
FeCl3 + 3NH4SCN → 3NH4Cl + Fe(SCN)3(р-р)
|
| Cu2+
| 1. Растворы солей Сu2+ окрашены в голубой цвет; Cu2+ окрашивает пламя в зеленый цвет.
2.Сероводород образует черный осадок сульфида меди CuS.
3.Гидроксиды щелочных металлов осаждают голубой осадок Сu(OH)2↓
4. Гидроксид меди растворяется в концентрированных растворах аммиака, образуя аммиакат меди интенсивно синего цвета (реактив Швейцера).
|
Cu2+ + S2-→ СuS↓
Cu2+ + 2OH-→ Сu(OH)2↓
Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH-
|
| Аммоний NH4+
| Взаимодействие солей аммония со щелочами при кипячении: При поднесении влажная лакмусовая бумажка окрасится в синий цвет.
| NН4+ + ОН-→NН3 + Н2О
|
| Качественные реакции на анионы
|
| S2-
| Из сульфидов растворимы сульфиды только щелочных металлов и аммония. Нерастворимые сульфиды имеют специфическую окраску, по которым можно определить тот или иной сульфид.
MnS— телесный (розовый). ZnS — белый. PbS — черный. Ag2S — черный. CdS — лимонно-желтый. SnS — шоколадный. HgS (метакиноварь) — черный. HgS(киноварь) — красный. Sb2S3— оранжевый. Bi2S3— черный.
| 1. Некоторые сульфиды при взаимодействии с кислотами-неокислителями образуют токсичный газ сероводород H2S с неприятным запахом (тухлых яиц): Na2S + 2HBr → 2NaBr + H2S↑ S2- + 2H+ → H2S↑
2. Некоторые устойчивы к разбавленным растворам HCl, HBr, HI, H2SO4, HCOOH, CH3COOH: CuS, Cu2S, Ag2S, HgS, PbS, CdS, Sb2S3, SnS и некоторые другие. Но они переводятся в раствор конц. азотной кислотой при кипячении (Sb2S3 и HgS растворяются тяжелее всего, причем последний гораздо быстрее растворится в царской водке): CuS + 8HNO3 →CuSO4 + 8NO2↑ + 4H2O
3. Также сульфид-анион можно выявить, приливая раствор сульфида к бромной воде: S2- + Br2 → S↓ + 2Br- Образующаяся сера выпадает в осадок.
|
| SО42-
| Сульфат-анион обычно осаждают катионом свинца, либо бария. Осадок сульфата свинца или сульфата бария белого цвета.
| Pb2+ + SО42-→ PbSO4↓
Ва2+ + SО42- →ВаSO4↓
|
| NО3-
| 1) добавить конц. H2SO4 и Си, нагреть
2) смесь H2S04 +FeSO4
| Образование голубогораствора, содержащего ионы Сu2+, выделение газа бурого цвета (NO2) Возникновение окраски сульфата нитрозо -железа (II) [Fe(H20)5NO]2+. Окраска от фиолетовой до коричневой(реакция «бурого кольца»)
|
| РО43-
| Ионы Ag+: выпадение светло-желтого осадка в нейтральной среде.
| З Аg + Р043-  Аg3Р04 Аg3Р04 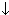
|
| СrO42-
| ионы Ва2+: выпадоние желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCI.
| Ва2+ + СrO42-  BaCr04 BaCr04 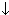
|
| СО32-
| ионы Са2+: выпадение белого осадка, растворимого в кислотах.
| Са2+ + С032- → СаСОз 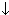
|
| SO32-
| ионы Н+: появление характерного запаха S02
| 2Н+ + SO32-  Н20 + S02↑ Н20 + S02↑
|
| F-
| ионы Са2+: выпадение белого осадка.
| Са2+ + 2F-  CaF2 CaF2
|
| Cl-
| ионы Аg+:выпадение белого осадка, не растворимого в HN03, но растворимого в конц. NH3 • Н20.
| Аg+ +CI-  AgCl AgCl 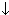 AgCI + 2(NH3• Н20) AgCI + 2(NH3• Н20)  [Ag(NH3)2]+ + CI- + 2Н2О [Ag(NH3)2]+ + CI- + 2Н2О
|
| Br-
| ионы Аg+: выпадение светло-желтого осадка, не растворимого в HN03
| Ag+ + Br- = AgBr  осадок темнеет на свету осадок темнеет на свету
|
| I-
| ионы Аg+: выпадение светло-желтого осадка, не растворимого в HN03 и NН3.
| Аg+ + I-  АgI АgI  осадок темнеет на свету осадок темнеет на свету
|

 Аg3Р04
Аg3Р04 
 BaCr04
BaCr04 
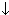
 Н20 + S02↑
Н20 + S02↑
 CaF2
CaF2
 AgCl
AgCl 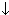 AgCI + 2(NH3• Н20)
AgCI + 2(NH3• Н20)  [Ag(NH3)2]+ + CI- + 2Н2О
[Ag(NH3)2]+ + CI- + 2Н2О
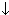 осадок темнеет на свету
осадок темнеет на свету
 АgI
АgI 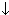 осадок темнеет на свету
осадок темнеет на свету


