 |
Нестехиометрические и смешанные соединения
|
|
|
|
(новейшие физические методы исследования позволили установить широкое распространение нестехиометрических и смешанных соединений среди многих классов неорганических соединений, которые правильнее обозначать тильдой перед стехиометрической формулой или чертой над формулой):

1) оксид железа (II), 2) сульфид меди (II) и железа (II) (халькопирит), 3) додекагидрат сульфата алюминия калия (алюминий-калий сульфат додекагидрат; алюминиевые квасцы; калий-алюминий сернокислый, 12-водный; калий-алюминий сульфат, 12-водный, алюмокалиевые квасцы); 4) основной силикат кальция–железа-магния (нефрит), ~Ca(Fe,Mg)5[Si4O11]2(OH)2, 5) гидратированный основной фосфат меди алюминия (бирюза) ˜ CuAl6 · [РО4] · 4[ОН]8·5Н2О, 6) оконное стекло ~Na2О · СaО · Si2О.
Задание 2. Назвать комплексное соединение, указав его тип, комплексообразователь, лиганд, внешнюю и внутреннюю сферу, коорди-национное число (по вариантам)
Вариант
1. Nа 2[Ве(ОН)4]
2. К3[Fе(СN)6].
3. [Сd(NH3)4]Cl2
4. [Сr(Н2О)4 Cl2]Cl
5. Nа3[Аl(ОН)6]
6. К2[Cu(СN)4]
7. [Рt(NH3)2Cl2]
8. К2[Zn(ОН)4]
9. К2[Zn(ОН)4]
10. К4[Fе(СN)6].
Задание 3 (по вариантам).
1. Напишите формулы веществ: фосфат аммония, гидрофосфат аммония, дигидрофосфат аммония.
2. Напишите формулы веществ: хлорид алюминия, хлорид гидро-ксоалюминия, хлорид дигидроксоалюминия
3. Какие элементы относятся к металлам: Na, N, S, I, F, Cl, K, Ca, Mg, Mn?
4. Укажите валентность и степень окисления атома кислорода в молекулах: О2, О3, Н2О, Н2О2, Н2SO4, Н3РО4.
5. Укажите валентность и степень окисления атома водорода в молекулах: Н2, НСl, Н2О, Н2О2, Н2SO4, Н3РО4.
6. Укажите валентность и степень окисления атома азота в молекулах, и ионах: N2, НN3, NН4Сl, N2О5, N2О3, НNO2, НNО3, NH4+.
7. Укажите валентность и степень окисления атома серы в молекулах и ионах: Н2SO3, Н2SО4, SO42-, SO32-, (NH4)2 SO4, (NH4)2 SO3, Аl2 S3, S.
|
|
|
8. С какими из перечисленных веществ будет взаимодействовать Сl2O7: оксид серы (VI), оксид калия, гидроксид магния, соляная кислота, оксид цинка?
9. С какими из перечисленных веществ будет взаимодействовать SiO2: оксид серы (VI), оксид калия, гидроксид магния, соляная кислота, оксид цинка?
10. С какими из перечисленных веществ будет взаимодействовать Na2O: оксид серы (VI), оксид калия, гидроксид магния, соляная кислота, оксид цинка?
Раздел 2.Типы химических реакций
Задание 4 (по вариантам)
1. Укажите тип химической реакции: N2 + O2 → 2NO; ΔH > 0.
2. Укажите химической реакции: H2 + ½ О2 → Н2О.
3. Укажите тип химической реакции: 2КМnO4 → K2MnO4 + MnO2 + О2.
4. Укажите тип химической реакции: Hg(NO3)2 + Cu → Нg↓ + Cu(NO3)2.
5. Укажите тип химической реакции: N2 + 3H2 ↔ 2NH3.
6. Определить ЭДС гальванического элемента Аu/Аu+//Мg/Мg2+ при концентрации солей 0,1 моль/л, температуре 273 К.
7. Определить ЭДС гальванического элемента Со/Со2+//Рb/Рb2+ при кон-центрации солей 1,5 моль/л, температуре 273 К.
8. Какая реакция среды будет при гидролизе солей Mg(СlO3)2, NН4NO2 в водном растворе, почему?
9. Какая реакция среды (рН<или>7) при гидролизе следующих солей: карбонат магния, сульфид цинка, ацетат бария, хлорид стронция.
10. Пойдет ли ионообменная реакция между Na2CO3 и Н2SO3? Напишите мо-лекулярное, ионные полное и краткое уравнения.
11. Пойдет ли ионообменная реакция между сульфидом калия и соляной кислотой? Напишите молекулярное, ионные полное и краткое уравнения.
12. Пойдет ли ионообменная реакция между карбонатом магния и соляной кислотой? Напишите молекулярное, ионные полное и краткое уравнения.
13. Пойдет ли ионообменная реакция между сульфидом кальция и серной кислотой? Напишите молекулярное, ионные полное и краткое уравнения.
14. Исходя из степени окисления йода и серы в соединениях Cr2(SO4)3; KJ; KJO3; Na2S и H2SO4, объясните, какие из них являются окислителями, какие восстановителями и какие могут проявлять как окислительные, так и восстановительные свойства?
|
|
|
15. Окисление или восстановление происходит при следующих превращениях: H2SO4  H2S; SO42-
H2S; SO42-  S2-; НClO4
S2-; НClO4  НCl; ClO4--
НCl; ClO4--  Cl-
Cl-
16. Окисление или восстановление происходит при следующих превращениях:
ClO2-  Cl2; Cr2O72-
Cl2; Cr2O72-  CrO32-; MnO42-
CrO32-; MnO42-  MnO4-?
MnO4-?
17. Какие металлы вытесняют водород из кислот? Дать развернутый ответ.
18. Какие металлы способны вытеснить медь из CuSO4? Дать развернутый ответ.
Раздел 3. Моль, молярная масса, молярная масса эквивалентов,
основные законы общей химии
Задание 5 (по вариантам)
1. Определить молярную массу и молярную массу эквивалента Н2SO4.
2. Определить молярную массу и молярную массу эквивалента CH3COOH.
3. Определить молярную массу и молярную массу эквивалента НNО2.
4. Определить молярную массу и молярную массу эквивалента Fe2(SО4)3.
5. Определить молярную массу и молярную массу эквивалента Na2С2О4.
6. Определить молярную массу и молярную массу эквивалента NaOH.
7. Какова масса 10 молей и 6,02 ·1023 молекул H2?
8. Сколько молекул содержится в 32 граммах O2?
9. Какой объем занимают 56 г N2 при н.у.
10. Какова масса в граммах 10 моль хлора?
11. Какова масса в граммах 1 моль атомарного йода?
12. Какова масса 1038 молекул кислорода?
13. Сколько молекул содержится в 21 г молекулярного азота?
14. Сколько молекул содержится в 5 г молекулярного брома?
15. Какой объём занимают 16 г CО2 при н.у.?
16. Какой объем занимают 1 г молекулярного хлора при 20°С, давлении 765 мм рт. ст.? (760 мм рт. ст. = 103,3 кПа).
17. Какой объем занимают 30 г О2 при температуре 19°С, давлении 770 мм рт.ст. (760 мм.рт.ст = 101,3 кПа)?
18. Какой объем занимают 16 г. Cl2 при температуре 10°С, давлении 750 мм рт. ст. (760 мм рт.ст = 101,3 кПа)?
19. Определить молярную массу эквивалента металла, (при его валентности I), если при сгорании 0,432 граммов металла образуется 0,464 граммов оксида.
20. Оксид марганца содержит 22,56% кислорода. Вычислите молярную массу эквивалента марганца в оксиде и составьте формулу.
21. В оксиде трехвалентного металла содержится 30,1% кислорода. Вычислите молярную массу эквивалента металла и укажите его название.
22. При н.у. 300 мл газа имеют массу 0,857 г. Определите молярную массу газа, его плотность по воздуху.
23. Определить плотность неизвестного газа по воздуху, если 1 л этого газа имеет массу 1,6 г.
|
|
|
24. Определить плотность водорода по неизвестному газу, если 1 л этого газа имеет массу 1,6 г.
25. Определить молярную массу эквивалента металла, если при сгорании его 65 г образуется 91 г оксида. Какой это металл, при условии, что его валентность равна 2?
26. Определить молярную массу эквивалента металла, если при сгорании его 3,1 г образуется 4,2 г оксида. Какой это металл, при условии, что его валентность равна 1?
27. Определить молярную массу эквивалента металла, если при сгорании его 4,00 г образуется 5,39 г оксида. Какой это металл, при условии, что его валентность равна 1?
28. На нейтрализацию 0,1 н раствора кислоты пошло 10 мл 0,05 н раствора щелочи. Какой объем раствора кислоты был взят?
29. На нейтрализацию 0,1 н раствора кислоты пошло 17 мл 0,15 н раствора щелочи. Какой объем раствора кислоты был взят?
30. На нейтрализацию раствора кислоты объемом 15 мл расходуется щелочь объемом 20 мл. Молярная концентрация эквивалента раствора щелочи 0,5 моль/л. Определите молярную концентрацию эквивалента кислоты.
Раздел 4. Теоретическая неорганическая химия.
Строение атома, химические связи
Задание 6 (по вариантам)
1. Какой атом завершается электронной формулой 4s24p4?
2. Какой атом завершается электронной формулой 6S26p2?
3. Какой атом завершается электронной формулой 4S23d2?
4. Какой атом завершается электронной формулой 4S23d8?
5. Какой атом завершается электронной формулой 6S25d1 4f1?
6. Какой атом завершается электронной формулой 6S25d1 4f1?
7. Сколько электронов, протонов, нейтронов в электронейтральном атоме Сu?
8. Сколько электронов, протонов, нейтронов в наиболее распространенном изотопе электронейтрального атома Ni?
9. Сколько электронов, протонов, нейтронов в наиболее распространенном изотопе электронейтрального атома Mn?
10. Сколько электронов, протонов, нейтронов в наиболее распространенном изотопе электронейтрального атома Ru?
11. Сколько электронов, протонов, нейтронов в наиболее распространенном изотопе электронейтрального атома Zn?
|
|
|
12. Сколько электронов, протонов, нейтронов в наиболее распространенном изотопе электронейтрального атома К?
13. Какой тип химической связи в молекуле Н-Н? Дать развернутый ответ.
14. Какой тип химической связи в молекуле H-I? Дать развернутый ответ.
15. Какой тип химической связи в молекуле H-F? Дать развернутый ответ.
16. Какой тип химической связи в молекуле Ca=O? Дать развернутый ответ.
17. Какой тип гибридизации центрального атома в молекуле СН4?
18. У какого из перечисленных атомов выше энергия ионизации: Сl, J, Br, F?
19. У какого из перечисленных атомов выше сродство к электрону: С, Si,
Ge, Sn?
20. Какая форма молекулы BН3? Дать развернутый ответ.
21. Какой тип гибридизации центрального атома в молекуле TiН4? Дать развернутый ответ.
22. Какой валентный угол связи в молекуле InН3? Развернутый ответ.
23. Составить эмпирическую и структурную формулу соединения: а) магния с кремнием; б) калия с азотом, руководствуясь их положением в периоди-ческой системе элементов.
24. Указать тип химической связи, тип гибридизации центрального атома, валентный угол и форму у молекул и ионов: ВСl3, СН4, РО43-, РF6.
25. Указать тип химической связи, тип гибридизации центрального атома, валентный угол и форму у молекул и ионов: [PСl 4]+, NO2- , АsO42-,
NH5, SH6.
26. Исходя из положения в Периодической системе, сравнить энергию ионизации и сродство к электрону атомов Сl и I. Какой из атомов сильнее проявляет неметаллические свойства?
27. Исходя из положения в Периодической системе, сравнить энергию ионизации и сродство к электрону атомов Сl и I. Какой из атомов сильнее проявляет металлические (неметаллические) свойства?
28. Пользуясь периодической системой, составьте формулы ванадиевой кис-лоты, высшего оксида молибдена, водородного соединения германия. Изобразите структурные формулы этих соединений.
29. Пользуясь периодической системой, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: Sr(OH)2 или Ba(OH)2?
30. Пользуясь периодической системой, дайте мотивированный ответ на вопрос: какая из двух кислот является более сильной: Н2SO4 или Н3РO4.
Раздел 5.Способы выражения концентраций растворов.
Определение рН растворов
Задание 7 (по вариантам)
1. Какова массовая доля NaОН в растворе с Сэ=1,1 моль/л, плотностью 1,045 г/мл?
2. Какова массовая доля Н2SO4 в растворе с С=0,83 моль/л, плотностью
1,05 г/мл?
3. Определить массовую долю раствора сульфата натрия, если 15 г соли растворили в 135 г воды.
4. Сколько граммов хлорида бария содержится в 25 мл раствора, молярная концентрация эквивалента которого равна 0,5 моль/л?
5. Сколько граммов фосфата натрия и воды необходимо взять для приготовления 300 г раствора с массовой долей соли 8%?
|
|
|
6. Раствор соляной кислоты массой 360 г содержит 72,0 г НСl. Плотность этого раствора равна 1,10 г/мл. Какова его молярная концентрация и молярная концентрация эквивалента?
7. Определить массовую долю раствора нитрата калия, если 20 г соли растворили в 400 г воды.
8. К 100 мл раствора соляной кислоты с массовой долей 20% и с плотностью 1,10 г/мл добавили 200 мл воды. Найти молярную концентрацию полученного раствора.
9. Какова массовая доля раствора нитрата кальция, если 35 г соли содержится в растворе объемом 500 мл, а плотность раствора составляет 1,2 г/мл?
10. Определить массовую долю раствора глюкозы, если 50 г глюкозы растворили в 250 г воды.
11. Сколько воды нужно добавить к 330 мл 8%-го раствора НСl, чтобы приготовить 0,1%-ный раствор?
12. Сколько воды нужно добавить к 200 мл 10%-го раствора НСl, чтобы приготовить 1%-ный раствор?
13. Сколько воды нужно добавить к 100 мл 30-%-го раствора НСl, чтобы приготовить 10%-ный раствор?
14. Сколько мл 20%-го раствора Аl2(SO4) 3 c плотностью 1,226 г/мл нужно для приготовления 100 мл раствора с молярной концентрацией эквивалента
Сэ = 0,1 моль/л?
15. Сколько мл 12%-го раствора ВаВr2 c плотностью 1,111 г/мл нужно для приготовления 100 мл раствора с молярной концентрацией эквивалента
Сэ = 0,1 моль/л?
16. Какой объем раствора серной кислоты с массовой долей кислоты 10% и с плотностью 1,07 г/мл потребуется для приготовления 40 мл раствора кислоты, молярная концентрация которого равна 0,40 М?
17. Какой объем раствора соляной кислоты с плотностью 1,07 г/мл и с массовой долей кислоты 14% потребуется для приготовления 500 мл раствора, молярная концентрация эквивалента которого равна 2 моль/л?
18. Какой объем раствора соляной кислоты с массовой долей 20% и с плотностью 1,10 г/мл потребуется для приготовления 300 мл 0,1 н раствора?
19. Рассчитайте рН 0,1 М раствора СН3COOH, Кр = 2,2 10–2.
20. Рассчитайте рН 0,01 М раствора НСlO, Кр = 5,0 10–8.
21. Рассчитайте рН 0,000001 М раствора Аl(ОН)3, Кр = 3,16 10–8.
22. Определить рН 0,05 молярного раствора NH4OH, если константа диссоциации гидроксида аммония равна 1,8 10–6.
23. Рассчитайте рН 0,0001 М раствора Н2SO4.
24. Рассчитайте рН 0,0001 М раствора NaOH.
25. Рассчитайте рН 0,0001 М раствора Ca(OH)2.
26. Рассчитайте рН 0,0005 М раствора НСl.
27. Определите концентрацию ионов серебра в насыщенном растворе соли AgVO3, если ее ПР = 5 · 10–7.
28. Определите концентрацию фосфат анионов в насыщенном растворе соли AlPO4, если ее ПР = 5,75 10–19.
29. Определите концентрацию ионов бария в насыщенном растворе соли BaCO3, если ее ПР = 4 10–10.
30. Определите концентрацию ионов кальция в насыщенном растворе соли СaC2O4, если ее ПР = 2,3 10–9.
Раздел 6.Управление химическими реакциями,
закон действующих масс
Задание 8 (по вариантам)
1. В каком направлении сместится равновесие обратимой реакции: 2 SO2 (г) + O2 (г) = 2 SO3 (г), ΔН° = –46 кДж/моль а) при повышении давления;
б) при понижении температуры.
2. Как изменится скорость реакции при уменьшении давления в 2 раза?
а) Н2 (г) + Cl2 (г) = 2 НCl (г).
б) 2Al (к) + 3Cl2 (г) = 2 AlCl3 (r)?
3. В каком направлении сместится равновесие реакции: СО2 (г) + С (к) =
= 2 СО (г), ΔН° = 86 кДж/моль а) при понижении давления; б) при повышении температуры.
4. Написать выражение для скорости прямой реакции: N2 (г) + О2 (г) = 2 NО (г). Как изменится скорость прямой реакции при увеличении концентрации азота и кислорода в 3 раза?
5. В каком направлении сместится равновесие реакции: N2 (г) + 3 Н2 (г) = 2 NН3 (г), ΔН° = –46 кДж/моль а) при повышении давления; б) при повышении температуры?
6. Реакция протекает по уравнению: N2 (г) + 3Н2 (г) = 2 NН3 (г). Как изменится скорость реакции, если концентрацию N2 увеличить в 3 раза, а концентрацию Н2 увеличить в 2 раза?
7. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 32 раза, принимая температурный коэффициент скорости реакции равным двум?
8. В каком направлении сместится равновесие реакции: 2 NО (г) + О2 (г) = 2 NО2 (г)?
а) при увеличении концентрации NО;
б) при уменьшении концентрации О2;
в) при уменьшении концентрации NО2.
9. Определить температурный коэффициент скорости реакции, если при понижении температуры на 50°С реакция замедлилась в 32 раза.
10. Как изменится скорость реакции, протекающей по уравнению: N2 (г) +
+ О2 (г) = 2 NО (г), если реакционную смесь вдвое обогатить кислородом при постоянном давлении?
11. Написать выражение для скорости прямой реакции: N2 (г) + О2 (г) = 2 NО (г). Как изменится скорость прямой реакции при увеличении температуры на 30°С, если температурный коэффициент скорости реакции равен двум?
12. В каком направлении сместится равновесие реакции: РCl3 (г) + Cl2 (г) = =РCl5 (г), ΔН° = –63 кДж/моль а) при понижении давления; б) при понижении температуры.
13. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 32 раза, если температурный коэффициент Вант-Гоффа принять равным двум?
14. Реакция протекает по уравнению А (г) + 2 В (г) = АВ2 (г). Определите, во сколько раз изменится скорость реакции если: а) уменьшить концентрацию вещества А в 2 раза; б) увеличить концентрацию вещества В в 3 раза.
15. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 32 раза, принимая тем-пературный коэффициент равным 2?
16. Во сколько раз увеличится скорость прямой реакции А + 2В = С, если концентрацию вещества А увеличить в 3 раза?
17. В каком направлении сместится равновесие экзотермической реакции
N2(г) +3 Н2(г) = 2NН3(г) при повышении давления?
18. В каком направлении сместится равновесие экзотермической реакции
N2(г) +3 Н2(г) = 2NН3(г) при повышении температуры?
19. Во сколько раз уменьшится скорость прямой реакции А + В = 2С, если концентрацию вещества А уменьшить в 3 раза?
20. В каком направлении сместится равновесие эндотермической реакции 2NO(г) + О2(г) = 2NО2(г) при понижении давления?
21. Во сколько раз уменьшится скорость прямой реакции А + В = 2С, если концентрации веществ А и В уменьшить в 2 раза?
22. В каком направлении сместится равновесие эндотермической реакции 2NO(г) + О2(г) = 2NО2(г) при повышении температуры?
23. Равновесные концентрации веществ в обратимой реакции 2 SO2 + O2  2 SO3 составляют (моль/л): [SO2] = 0,0002; [O2] = 0,004; [SO3] = 0,003. Вычислить константу равновесия.
2 SO3 составляют (моль/л): [SO2] = 0,0002; [O2] = 0,004; [SO3] = 0,003. Вычислить константу равновесия.
24. Рассчитать, как изменится скорости прямой реакции при увеличении давления вдвое в системах: H2 + J2  2 HJ и 2 NO + O2
2 HJ и 2 NO + O2  2 NO2, в какую сторону сместится равновесие?
2 NO2, в какую сторону сместится равновесие?
25. Реакция между оксидом азота и хлором протекает по уравнению 2 NO + +Cl2  2 NOCl. Как изменится скорость реакции при увеличении:
2 NOCl. Как изменится скорость реакции при увеличении:
а) концентрации оксида азота в два раза;
б) концентрации хлора в два раза.
в) концентрации обоих веществ в два раза?
26. Как отразится повышение давления на равновесие в системах: а) 2 Н2 (г) + +О2 (г)  2 Н2О (ж); б) СО2 (г) + С (тв)
2 Н2О (ж); б) СО2 (г) + С (тв)  2 СО (г); в) СаСО3 (тв)
2 СО (г); в) СаСО3 (тв)  СаО (тв) + СО2 (г)?
СаО (тв) + СО2 (г)?
27. Реакция горения этана выражается термохимическим уравнением: С2Н6 (г) +31/2 O2=2CO2 (г) +ЗН2О (ж); ΔH х.р= —1559,87 кДж. Вычислите теплоту образования этана, если известны теплоты образования СО2 (г) и Н2О(ж).
28. Быстрее будет протекать реакция при комнатной температуре цинка с соля-ной кислотой концентрации 10% или 30%, почему?
29. Быстрее будет протекать реакция при комнатной температуре железа с соляной кислотой концентрации 5% или 15 %, почему?
30. Как повлияет увеличение давления на смещение обратимой реакции
2СО + О2 ↔ 2СО2
31. В каком направлении сместится равновесие экзотермической реакции
N2 (г) +3 H2 (г) = 2NH3 (г) при повышении температуры?
32. При температуре 334 К реакция заканчивается за 18 мин. За какое время эта реакция заканчивается при 374 К, если температурный коэффициент равен двум?
33. При температуре 304 К реакция заканчивается за 18 мин. За какое время эта реакция заканчивается при 274 К, если температурный коэффициент равен двум?
34. При температуре 265 К реакция заканчивается за 10 мин. За какое время эта реакция заканчивается при 245 К, если температурный коэффициент равен двум?
35. При температуре 265 К реакция заканчивается за 16 мин. За какое время эта реакция заканчивается при 275 К, если температурный коэффициент равен двум?
Раздел 7. Основы органической, аналитической
и физколлоидной химии. Прикладная химия
Задание 9 (по вариантам)
1. Каковы основные применения Са(ОН)2 (гидроксид кальция, гашеная известь, пушонка) и СаО (негашеной извести)?
2. Каковы основные направления практического применения NaНCO3 и Na2CO3?
3. С60, С120 (фуллерены) имеет в качестве основных следующие практические применения (указать).
4. Аналитическая химия. Качественный и количественный анализ. Методы качественного и количественного анализов: химические, физико-химические и физические. На чем основаны химические методы.
5. Титриметрический и гравиметрический анализы. Инструментальные методы: спектральные (оптические), электрохимические, распределительные (хромато-графические) и радиометрические.
6. Виды дисперсных систем: грубая, коллоидные и истинные (молекулярные и ионные) растворы. Растворы в зависимости от размера частиц: ионные (<10–3), молекулярные, коллоидные.
7. Гетерогенные системы (взвеси, суспензии, эмульсии).
8. Какие растворы являются буферными?
9. В какой цвет окрашивает пламя газовой горелки различные ионы?
10. На чем основаны физические и физико-химические методы качественного и количественного анализа?
11. Какие методы объединяют в инструментальные?
12. Химический состав продуктов питания.
13. Укажите функциональные группы, классы и названия органических соединений (по систематической международной номенклатуре и тривиальное):
| СН2 – СН – СН2 | | | OH OH OH | 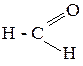
|
| А) | Б) |
14. Укажите функциональные группы, классы и названия органических соединений (по систематической международной номенклатуре и тривиальное):

| 
|
| А) | Б) |
15. Укажите функциональные группы, классы и названия органических соединений (по систематической международной номенклатуре и тривиальное):

| 
|
| А) | Б) |
16. Укажите функциональные группы, классы и названия органических соединений (по систематической международной номенклатуре и тривиальное):

| 
|
| А) | Б) |
17. Укажите функциональные группы, классы и названия органических соединений (по систематической международной номенклатуре и тривиальное):

| O || CH3 – CH2 – C – CH2 – CH3 |
| А) | Б) |
18. Укажите функциональные группы, классы и названия органических соединений (по систематической международной номенклатуре и тривиальное):

| 
|
| А) | Б) |
19. Укажите функциональные группы, классы и названия органических соединений (по систематической международной номенклатуре и тривиальное):

| 
|
| А) | Б) |
Задание 10
Дайте описание, чем различаются виды дисперсных систем: грубая, коллоидные и истинные (молекулярные и ионные) растворы. Что такое гетерогенные системы (взвеси, суспензии, эмульсии) – их принципиальные отличия.
Задание 11 (по вариантам)
1. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
2. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
3. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
4. Как называется то, что изображено на рисунке?

| 
|
| А) | Б) |
5. Как называется тип химической посуды, изображенной на рисунке?

| 
| 
|
| А) | Б) | В) |
6. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
7. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
8. Как называется тип химической посуды, изображенной на рисунке?

| 
| 
|
| А) | Б) | В) |
9. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
10. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
11. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
12. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
13. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
14. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
15. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
16. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
17. Как называется изображенное на рисунке?

| 
|
| А) | Б) |
18.Как называется изображенное на рисунке?

| 
|
| А) | Б) |
19. Как называется тип химической посуды, изображенной на рисунке?

| 
|
| А) | Б) |
СОДЕРЖАНИЕ
Пояснительная записка................................................................................. 3
Рабочая программа...................................................................................... 3
1 Цель и задачи дисциплины..................................................................... 4
2 Общие методические указания по изучению дисциплины и выполнению контрольной работы........................................................................................................ 4
3 Структура и содержание дисциплины................................................... 6
Раздел 1. Химия: основные понятия. Валентность, степень окисления, эмпирические и структурные формулы соединений. Классы, названия соединений и их основные свойства................................................................................................... 7
Раздел 2. Типы химических реакций.................................................... 15
Раздел 3. Моль, молярная масса, молярная масса эквивалентов, основные законы общей химии.......................................................................................... 18
Раздел 4. Теоретическая неорганическая химия. Строение атома, химические связи................................................................................................................ 19
Раздел 5. Способы выражения концентраций растворов. Определение рН растворов................................................................................................................ 20
Раздел 6. Управление химическими реакциями, закон действующих масс 21
Раздел 7. Основы органической, аналитической и физколлоидной химии. Прикладная химия..................................................................................................... 23
Задания к выполнению контрольной работы......................................... 26
Выбор номера варианта....................................................................... 26
Выбор номеров вопросов..................................................................... 27
Вопросы к контрольной работе........................................................... 27
Приложение 1. Формы вопросов тренировочного теста
Приложение 2. Дополнительная литература
Приложение 1
|
|
|


