 |
Растворимость осадка в отсутствие избытка одноименного иона будет равна
|
|
|
|
Вопросы и примеры задач для подготовки к К/Р №1
Количественный анализ
Гравиметрический анализ
Гравиметрический анализ
- Гравиметрический анализ. Основы метода.
- Образование осадков. Свойства осадков.
- Факторы, влияющие на растворимость осадков.
- Схема образования осадков. Кинетический и термодинамический подходы.
- Условия аналитического осаждения.
- Осаждение из первоначально гомогенного раствора (метод возникающих реагентов).
- Старение осадков. Его виды и применение в гравиметрии.
- Загрязнение осадков. Общая характеристика.
- Загрязнение осадков вследствие адсорбции. Виды адсорбции.
- Загрязнение осадков вследствие образования твердых растворов (сокристаллизация).
- Загрязнение осадков вследствие захвата ионов.
- Процессы, протекающие при прокаливании осадков. Выбор температуры прокаливания.
- Важнейшие органические и неорганические осадители, их характеристика.
- Требования к осаждаемой и гравиметрической формам.
- Основные источники систематических ошибок в гравиметрии.
Пример 1. Вычислить фактор пересчета для определения калия, если после осаждения его в виде K2PtCl6 гравиметрической формой является Pt.
Решение. Из цепочки превращений
2K®K2PtCl6®Pt
следует, что 2 молям K соответствует 1 моль Pt. Фактор пересчета равен:
 .
.
Пример 2. Рассчитать массу силикатной породы, содержащей около 5% CaO, которая необходима для получения 0.3 г CaSO4.
Решение. Фактор пересчета
 .
.
Масса m (CaO) в силикатной породе

Отсюда для массы силикатной породы имеем

Пример 3. Какой объем 2%-го раствора AgNO3 потребуется для осаждения хлорида из навески CaCl2×6H2O массой 0.4382 г?
Решение. Находим массу, необходимую для осаждения хлорид-ионов
|
|
|

Объем раствора будет равен
 .
.
Пример 4. Из навески каменного угля массой 2.6248 г после соответствующей обработки получили 0.3248 г BaSO4. Вычислить массовую долю (%) серы в каменном угле. Пересчитать массовую долю (%) на сухое вещество, если содержание влаги в образце 2.58 %.
Решение. Фактор пересчета
 .
.
Масса серы в образце равна:
m (S)= F × m (BaSO4)=0.04462 г.
Содержание серы в образце
 .
.
В пересчете на сухое вещество
 .
.
Пример 5. При определении оксидов щелочных металлов из образца силикатной породы массой 1.2505 г выделили смесь NaCl и KCl массой 0.1500 г. После обработки этой смеси серной кислотой получили сульфаты Na2SO4 и K2SO4 массой 0.1800 г. Вычислить массовую долю (%) Na2O и K2O в силикатной породе.
Решение. Факторы пересчета Na2O и K2O в хлориды и сульфаты будут следующими:
 ,
, 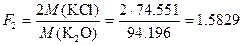
 ,
, 
Массы хлоридов и сульфатов будут соответственно равны:
 ,
,
 .
.
Решая полученную систему уравнений и деля найденные массы оксидов на массу образца, получаем: w (Na2O)=4.28%, w (K2O)=2.48%.
Пример 6. Вычислить потери (г и %) за счет растворимости осадка СаС2О4×H2O, если к 20 мл 0,1 М CaCl2 добавили: а) эквивалентное количество 0,1 М (NН4)2С2О4; б) полуторный избыток 0,1 М (NН4)2С2О4
Решение. а) Масса осадка СаС2О4×Н2О (М=146,12), образующегося при осаждении, равна
 .
.
Объем раствора после добавления эквивалентного количества осадителя 20+20=40 мл; ПР (CaC2O4)=2.3×10–9. Отсюда  . Потеря оксалата кальция за счет растворимости составит
. Потеря оксалата кальция за счет растворимости составит

или

б) При использовании полуторного избытка осадителя масса осадка остается практически неизменной - 0,2922 г СаС2О4×Н2О. Объем раствора после осаждения равен 20+20×1,5=50 мл. При добавлении полуторного количества осадителя избыток его составляет 10 мл 0.1 М. Концентрация ионов С2О42– в полученном растворе будет составлять 0.1×10/50= 0.02 М. Поскольку в растворе находится избыток С2О42– растворимость СаС2О4 будет определяться концентрацией ионов кальция и
 или
или  , что составляет 2.9×10–4 %.
, что составляет 2.9×10–4 %.
|
|
|
Пример 7. Сколько процентов составят потери за счет растворимости при промывании 0,2 г осадка Мg(ОН)2 250 мл воды? Какова должна быть концентрация аммиака в промывной жидкости, чтобы потери промывании осадка таким же объемом составляли не более 0,1%?
Решение. На основании ПР=[Mg2+][OH-]2=6,0×10-19 определяем концентрацию Мg2+ и равную ей концентрацию Мg(ОН)2 в насыщенном растворе. Согласно уравнению реакции
Mg(OH)2ÛMg2++2OH-
Растворимость осадка в отсутствие избытка одноименного иона будет равна

Значит потери за счет растворимости Мg(ОН)2 (М =58,320) в 250 мл составляют 5,31×10-4×0,250×58,320=7,74×10-3 г Mg(OH)2 или 3,87%
При использовании в качестве промывной жидкости раствора аммиака растворимость Mg(OH)2 понижается за счет введения одноименных с осадком ионов OH-. Зная, что потери должны составлять 0,1%, находим растворимость Mg(OH)2:

Следовательно, [Мg2+]=1,37×10-5 M. Отсюда, на основании произведения растворимости, имеем

На основании константы диссоциации NН3

вычисляем концентрацию NН3 в растворе, в котором [ОН-]=6,62×10-8 M. Так как в водном растворе аммиака [NH4+]=[ОН-], то из константы диссоциации следует

Пример 8. Произведения растворимостей BaCO3 и PbCO3 соответственно равны 8×10-9 и 7.3×10-14. Из раствора, содержащего 0.001 M Ba2+ и 10-5 Pb2+, осаждается половина бария. Какова теоретическая молярная доля PbCO3 в осадке:
а) если ни какого соосаждения не происходит,
б) если происходит равномерное распределение примеси,
в) если происходит логарифмическое распределение примеси?
Решение.
а) После осаждения половины бария, [Ba2+]=5×10-4 M. Концентрация карбонат-иона, [CO32-]=8×10-9/5×10-4 =4×10-5 M. При этой концентрации карбоната [Pb2+]=7.3×10-14/4×10-5=1.83×10-9 M, т.е. свинец практически полностью переходит в осадок. Отсюда молярная доля PbCO3 в осадке

б)  , D=8×10-9/7.3×10-14=1.10×105.
, D=8×10-9/7.3×10-14=1.10×105.  , x» a =10-5,
, x» a =10-5,

в) l=1.10×105,  ,
,  ,
,  .
.
x» a =10-5, 
Пример 9. Произведения растворимостей BaCO3 и PbCO3 соответственно равны 8×10-9 и 7.3×10-14. К 1 л раствора, содержащего 0.001 M Ba2+ и 10-5 Pb2+, добавляют 0.0011 М карбоната. Каковы концентрации катионов бария и свинца, оставшихся в растворе,
а) если никакого соосаждения не происходит,
б) если происходит равномерное распределение примеси,
в) если происходит логарифмическое распределение примеси?
|
|
|
Решение.
а) После добавления карбоната в осадок практически полностью выделяется ион бария. Если в первом приближении пренебречь образованием PbCO3, то [CO32-]=0.0011-0.001=10-4 M. Произведение концентраций [Pb2+]in×[CO32-]=10-9 > 7.3×10-14. Другими словами, в осадок будут выделяться оба катиона. В соответствии с этим
[CO32-]=0.0011-0.001-10-5+8×10-9/[CO32-]+7.3×10-14/[CO32-].
Решением этого квадратного уравнения является [CO32-]=1.45×10-4 М.
Отсюда для равновесных концентраций катионов в растворе получаем:
[Ba2+]end=8×10-9/1.45×10-4=5.5×10-5 М, [Pb2+]end=7.3×10-14/1.45×10-4=5.0×10-10 М
б) Из пункта а) следует, что как барий, так и свинец практически полностью выделяются в осадок. Если принять, что образующийся твердый раствор является идеальным, то активность соответствующего компонента в твердой фазе будет равна его молярной доле в ней:
a (PbCO3)=10-5/(0.001+10-5)=9.9×10-3»0.01, a (BaCO3)»1-0.01=0.99.
[Pb2+]end×[CO32-]=ПР(PbCO3)× a (PbCO3), [Pb2+]end=7.3×10-14×0.01/1.45×10-4=5.0×10-12 М
[Ba+]end×[CO32-]=ПР(BaCO3)× a (BaCO3), [Ba2+]end=8×10-9×0.99/1.45×10-4=5.6×10-5 М
в) l=8×10-9/7.3×10-14=1.10×105,  ,
,
 ,
,  , [Pb2+]end»0.
, [Pb2+]end»0.
Задачи
1. Какую навеску пирита, содержащего около 30% серы нужно взять для анализа, чтобы получить 0,3 г осадка BaSO4?
2. Вычислить фактор пересчета, если при определении мышьяка сначала осадили As2S3, затем окислили серу до SO42-, осадили сульфат хлоридом бария и взвесили BaSO4?
3. Какую навеску Fe3O4 следует взять для получения 1,0 г Fe2O3?
4. Определение содержания серы выполняют по схеме S®H2S®CdS®CuS®CuO. Вычислить фактор пересчета для определения S по CuO.
5. Вычислить фактор пересчета для определения HF, если анализ выполняли по схеме: HF®CaF2®CaSO4.
6. Для определения сульфата в растворе Fe2(SO4)3 осадили Fe(OH)3 и после прокаливания осадка получили гравиметрическую форму Fe2O3. Вычислить фактор пересчета.
7. Вычислить фактор пересчета для определения P2O5, если анализ выполняли по схеме: P2O5®PO43–®(NH4)3PO4×12MoO3®PbMoO4.
8. Вычислить фактор пересчета для определения калия, если после осаждения его в виде K2PtCl6 получена гравиметрическая форма платины.
9. Вычислить фактор пересчета для определения тиосульфата натрия, если после окисления и осаждения получена гравиметрическая форма BaSO4.
|
|
|
10. Вычислить фактор пересчета для определения CaO, если анализ выполняли по схеме: CaO®Ca3(PO4)2®Mg2P2O7.
11. Вычислить фактор пересчета для определения NH3 по хлорплатинатному методу, при котором гравиметрической формой является металлическая платина (NH3®(NH4)2PtCl6®Pt).
12. Сколько вещества, содержащего около 50% железа, следует взять для анализа, чтобы масса прокаленного осадка Fe2O3 была 0,1 г?
13. Анализ карбида кальция выполняли по схеме CaC2®H2C2®Ag2C2®AgCl. Вычислить фактор пересчета для определения CaC2.
14. Смесь бромида и иодида серебра содержит по массе 55,25 % серебра. Вычислить процентное содержание каждой соли в смеси.
15. Рассчитать навеску вещества, содержащего около 1% K2SO4 и 3% KCl, необходимую для получения 0,2 г осадка KClO4.
16. При анализе 0,6528 г вещества получили 0,2825 г смеси сульфатов калия и магния. Масса Mg2P2O7, выделенного из этой смеси, составила 0,1536 г. Вычислить процентное содержание оксидов калия и магния в анализируемом веществе.
17. Из навески 1,0000 г силикатной породы получили смесь солей NaCl и KCl общей массой 0,1015 г. Из этой смеси получили осадок K2PtCl6 0,2040 г. Вычислить процентное содержание Na2O и K2O в силикате.
18. Сульфат алюминия содержит около 88% Al2(SO4)3×18H2O. Рассчитать навеску, необходимую для определения алюминия в виде Al2O3, если масса Al2O3 0,1 г.
19. Какой объем 0,1 М AgNO3 потребуется для осаждения хлора из 1,0 г смеси, содержащей одинаковые массы BaCl2×2H2O и NaCl, если осадитель добавляется в стехиометрическом соотношении?
20. Вычислить потери Са (г и %) за счет растворимости осадка СаС2O4, если к 20 мл раствора, содержащего 0.1 г кальция, прибавили 35 мл 0,25 М (NH4)2C2O4.
21. Сколько процентов составят потери за счет растворимости AgCl при осаждении 0,15 г хлорида эквивалентным количеством нитрата серебра в 1 л раствора?
22. Сколько миллилитров 0,1 н. (NH4)2SO4 нужно прибавить к 300 мл воды, чтобы при промывании осадка 0,5 г BaSO4 этим раствором потери за счет растворимости не превышали 0,01%?
23. Сколько миллилитров 25%-ного NH3 нужно добавить к 150 мл промывной жидкости, чтобы при промывании осадка MgNH4PO4 потери за счет растворимости составили не более 0,0001 г MgO?
24. Вычислить потери PbSO4 (г и %) за счет растворимости осадка, полученного при добавлении к 20 мл 0,1 М Pb(NO3)2 и полуторного избытка 0,1 М H2SO4
25. Сколько миллилитров 0,1 М (NH4)2CO4 необходимо для осаждения кальция и стронция из 200 мл раствора, содержащего в 1 л 0,555 г СаСl2 и 0,317 г SrCl2, если осадитель добавляют в стехиометрическом количестве?
|
|
|


