 |
Блот-гибридизация по саузерну
|
|
|
|
Лабораторная работа № 6
ТЕМА: МЕТОДЫ ИЗУЧЕНИЯ ДНК
Цель работы: изучить методы рестрикционного картирования ДНК, блот-гибридизации по Саузерну, гибридизации in situ
Задание: изучить последовательность действий при составлении рестрикционной карты ДНК, записать выделенные термины, ответить на вопросы, сделать вывод об эффективности этого метода по определению структуры ДНК.
ВЫДЕЛЕНИЕ И СИНТЕЗ ДНК
ДНК может быть изолирована из любого типа тканей и клеток, содержащих ядра. Этапы выделения ДНК включают быстрый лизис клеток, удаление с помощью центрифугирования фрагментов клеточных органелл и мембран, ферментативное разрушение белков и их экстрагирование из раствора с помощью фенола и хлороформа, концентрирование молекул ДНК путем преципитации в этаноле. Из 1 г сырой ткани или из 109 клеток обычно получают 2 мг ДНК.
У человека ДНК чаще всего выделяют из лейкоцитов крови, для чего собирают от 5 до 20 мл венозной крови в стерильную пробирку с раствором, препятствующим коагуляции (например, с глюгициром или гепарином). Затем отделяют лейкоциты и разрушают клеточные и ядерные мембраны добавлением буферных растворов, содержащих денатурирующие агенты. Наилучшие результаты при выделении ДНК дает применение протеиназы К с последующей фенол-хлороформной экстракцией разрушенных белков. ДНК осаждают в этаноле и растворяют в буферном растворе.
Оценку качества экстрагированной ДНК проводят на основании измерения оптической плотности раствора ДНК в области белкового и нуклеинового спектров поглощения. В чистых образцах ДНК соотношение А(260)/А(280) > 1,8; где А(260) и А(280) - оптическая плотность раствора при длине волны 260 и 280 нм, соответственно. В противном случае процедуру очистки необходимо повторять, так как для успешного использования и хранения ДНК белки должны быть полностью удалены.
|
|
|
В процессе сложного и многообразного функционирования различные участки хромосом и ДНК претерпевают разнообразные регулируемые и в основе своей обратимые изменения. Эти модификации осуществляются с помощью специальных белков - ферментов.
Ферменты, осуществляющие синтез ДНК, называются ДНК-полимеразами. И в бактериальных клетках, и в клетках эукариот содержатся три различные формы ДНК-полимераз, все они обладают синтезирующей активностью и способны удлинять цепи ДНК в направлении 5'-3', последовательно прибавляя по одному нуклеотиду к 3'-ОН-концу цепи, причем точность синтеза определяется специфичностью спаривания оснований. Таким образом, для работы ДНК-полимеразы необходима однонитевая матричная ДНК с двухнитевым участком на 3'-конце молекулы. Кроме того, в среде должны присутствовать четыре типа дезоксинуклеотидтрифосфатов (dNTP: dATP, dCTP, dGTP и dTTP) - молекул, состоящих из основания - А, С, G или Т, сахара - дезоксирибозы (d) и трех (Т) фосфатных остатков (Р). В клетках эукариот репликацию осуществляет ДНК-полимераза α, а в клетках Е. coli — ДНК-полимераза III. ДНК-полимеразы обладают различными активностями, в том числе и экзонуклеазной в направлении 3'-5', что позволяет им исправлять - репарировать — дефекты, допущенные при подборе комплементарных оснований. ДНК-полимераза I Е. coli способна инициировать репликацию в месте разрыва ДНК и замещать гомологичный участок в двойной цепи ДНК. Это свойство используется для введения в ДНК меченых нуклеотидов методом ник-трансляции.
РЕСТРИКЦИЯ ДНК
У прокариотических организмов обнаружены специализированные ферменты, выполняющие функцию сохранения структуры ДНК. Они получили название рестрикционные эндонуклеазы, или рестриктазы (от позднелат. restrictio-ограничение).
|
|
|
Рестриктазы впервые были выделены из Е. coli в 1968 г. Оказалось, что они способны разрезать (плавить) молекулы ДНК на разных сайтах (местах) рестрикции. Эти ферменты получили название эндонуклеаз класса I. Затем у бактерий были обнаружены эндонуклеазы класса II, которые распознают в чужеродной ДНК сайты рестрикции специфически и на этих сайтах тоже осуществляют рестрикцию. Именно ферменты этого класса стали использовать в генной инженерии. Тогда же были открыты ферменты класса III, которые плавят ДНК рядом с сайтами распознания, но эти ферменты не имеют значения в генной инженерии.
Действие системы рестрикции-модификации «рационализуется» так называемыми палиндромными (распознающими последовательностями) азотистых оснований, которые являются сайтами рестрикции ДНК. Палиндромные последовательности — это последовательности оснований, которые одинаково читаются вперед и назад, как, например, последовательность букв радар. Поскольку цепи ДНК обладают антипараллельным направлением, то считают, что последовательность является палиндромной, если она идентична, когда читается в направлении от 5'- к 3'-концу на верхней (левой) и 3'- к 5'-концу на нижней (правой) цепи.
У бактерий системы рестрикции-модификации являются внутриклеточной иммунной системой защиты от чужеродной ДНК. В отличие от высших организмов, у которых распознание и разрушение вирусов, бактерий и других патогенов происходит внеклеточно, у бактерий защита от чужеродной ДНК (ДНК растений и животных, в организме которых они обитают) происходит внутриклеточно, т. е. тогда, когда чужеродная ДНК проникает в цитоплазму бактерий. С целью защиты бактерии в ходе эволюции развили также способность «метить» собственную ДНК метилирующими основаниями на определенных последовательностях. По этой причине чужеродная ДНК из-за отсутствия в ней метальных групп на тех же последовательностях плавится (разрезается) на фрагменты разными бактериальными рестриктазами, а затем деградируется бактериальными экзонуклеазами до нуклеотидов. Можно сказать, что таким образом бактерии защищают себя от ДНК растений и животных, в организме которых они обитают временно (как патогены) или постоянно (как сапрофиты).
|
|
|
Открытие бактериальных ферментов, обладающих эндонуклеазной активностью, значительно продвинуло исследование структуры ДНК и возможности генноинженерного манипулирования с молекулами ДНК. Рестриктазы позволили вырезать интересующие фрагменты (гены) из больших молекул ДНК. Поскольку известно более 500 ферментов рестрикции, то это дает возможность с помощью различных рестриктаз селективное вырезать фрагменты из исходной ДНК.
Замечательной особенностью рестриктаз является то, что они продуцируют разрезы молекул на несколько фрагментов (рестриктов) ДНК уступами, в результате чего в образующихся концах одна цепь длиннее другой, образуя своеобразный хвост. Такие концы (хвосты) получили название «липких» концов, т. к. они способны к самокомплементарности (рис. 1).
Рестриктазы узнают палиндромы любых размеров, но большинство тех палиндромов, которые используют в качестве сайтов узнавания рестриктазами, состоят из 4, 5, 6 и реже 8-12 нуклеотидов в двухцепочечной молекуле ДНК и разрезают ее на фрагменты в местах локализации этих последовательностей, называемых сайтами рестрикции. Количество образующихся рестрикционных фрагментов ДНК определяется частотой встречаемости сайтов рестрикции, а размер фрагментов - характером распределения этих сайтов по длине исходной молекулы ДНК. Чем чаще расположены сайты рестрикции, тем короче фрагменты ДНК после рестрикции. В настоящее время известно более 500 различных типов рестриктаз бактериального происхождения, причем каждый из этих ферментов узнает свою специфическую последовательность.
Рестриктазы выделяют путем биохимической очистки из различных видов бактерий и обозначают тремя буквами, соответствующими первым трем буквам латинского названия вида бактерий, и римской цифрой, соответствующей хронологии открытия этого фермента у данного вида. В зависимости от частоты встречаемости сайтов рестрикции в молекуле ДНК различают три класса рестриктаз: часто-, средне- и редкощепящие. Естественно, что рестриктазы, узнающие длинные специфические последовательности (8-12 п.о.), как правило, являются редкощепящими, а узнающие короткие - (4-5 п.о.) - частощепящими.
|
|
|

Рис. 1. Последовательность нуклеотидов в ДНК, узнаваемая тремя наиболее часто используемыми рестриктазами. Рестрикцирующие нуклеазы получают из различных бактерий: НРА I - Haemophilus parainfluenzae; Eco RI - из Escherichia coir, Hind III - из Haemophilus influenzae. Рестриктазы типа 1 расщепляют ДНК с образованием "слепых" концов, а другие (типа 2) с образованием по месту разрыва одноцепочечных "липких" концов.
Вслед за рестрикцией ДНК из рестрикционной смеси выделяют рестрикционные ДНК-фрагменты (ДНК-рестрикты), которые необходимы затем для объединения с вектором. Для выделения ДНК-рестриктов прибегают к электрофорезу, поскольку с помощью этого метода рестрикцированную ДНК очень легко фракционировать благодаря размерам фрагментов-рестриктов и благодаря константным отношениям электрический заряд-масса. Фрагменты в электрическом поле мигрируют в ходе электрофореза при частоте, зависимой от их размеров (массы). Чем больше (длиннее) фрагмент, тем медленнее он мигрирует в электрическом поле. Материалом, в котором проводят электрофорез, являются незаряжающиеся агароза и полиакриламид. Для опознания фрагментов используют этидий бромид, который красит фрагменты, что ведет к их более легкому обнаружению.
Результативность электрофореза очень высока, поскольку с его помощью могут быть разделены фрагменты, размеры которых составляют от 2 до 50 000 оснований.
Обычным методом выявления ДНК в геле, так же как и РНК, является ее специфическое окрашивание, чаще всего бромидом этидия, и просмотр геля в проходящем свете ультрафиолетовой области спектра. При этих условиях места локализации ДНК имеют красную окраску. При использовании для рестрикции нескольких эндонуклеаз с последующим электрофоретическим анализом перекрывающихся аддитивных по длине фрагментов ДНК можно добиться полного упорядочивания сайтов узнавания для каждого из ферментов относительно друг друга и каких-то иных маркеров, присутствующих в исследуемой молекуле ДНК. Процесс этот называется физическим картированием и является обязательным элементом анализа плазмидных, вирусных, бактериальных ДНК и относительно небольших фрагментов ДНК эукариот. В практическом плане рестрикционные карты позволяют определять не только размеры рестриктов, но и выяснять расположение в молекулах ДНК локусов тех или иных генов.
На рис. 2 представлен простейший пример такого картирования в том случае, когда в исследуемой молекуле ДНК присутствуют два сайта рестрикции — по одному для двух эндонуклеаз. После обработки исходной ДНК отдельно каждой из рестриктаз образуются два фрагмента, соответствующие по длине расстоянию от концов молекулы ДНК до сайтов рестрикции. При совместной обработке обеими эндонуклеазами на электрофореграмме появляется новый фрагмент, размер которого соответствует расстоянию между сайтами рестрикции.
|
|
|

Рис. 2. Рестрикционное картирование.
Очевидно, что эти данные еще не позволяют однозначно определить положение сайтов рестрикции по отношению к концам молекулы ДНК. Однако достаточно знать расположение хотя бы одного маркера для того, чтобы произвести точное физическое картирование исходной молекулы ДНК независимо от количества локализованных в ней сайтов рестрикции.
Поскольку у высших организмов в ходе транскрипции синтезируется гетерогенная ДНК, корректируемая процессингом, то в генной инженерии обычно используют комплементарную ДНК (кДНК), которую получают при использовании в качестве матрицы мРНК, на которой обратная транскриптаза синтезирует одноцепочечную ДНК (кДНК), являющуюся копией мРНК. В последующем эти одноцепочечные ДНК превращают в двухцепочечные ДНК. Считают, что кДНК содержит непрерывные нуклеотидные последовательности (транскрибируемые и транслируемые). Именно кДНК используют для рестрикции.
Однако, при обработке тотальной геномной эукариотической ДНК, в частности, ДНК человека, часто- или среднещепящими эндонуклеазами образуется так много фрагментов различной длины (в среднем порядка 1 млн), что их не удается разделить с помощью электрофореза, т. е. не удается визуально идентифицировать отдельные фрагменты ДНК на электрофореграмме. После электрофореза рестрицированной геномной ДНК получается равномерное окрашивание по всей длине геля - так называемый шмер.
Идентификация нужных фрагментов ДНК в таком геле возможна только путем гибридизации с мечеными ДНК-зондами. Это достигается при помощи метода блот-гибридизаиии по Саузерну.
БЛОТ-ГИБРИДИЗАЦИЯ ПО САУЗЕРНУ
Одним из эффективных методов идентификации определенных молекул ДНК среди электрофоретически разделенных фрагментов является ставший уже классическим метод блот-гибридизации по Саузерну, по фамилии автора (Edward Southern), предложившего данный метод в 1975 г. Последовательные этапы данного метода представлены на рис. 3. Суть метода - рестрикция геномной ДНК одной или несколькими рестриктазами, после чего образующиеся фрагменты разделяются по относительной молекулярной массе в агарозном или акриламидном гелях. Затем ДНК подвергается денатурации in situ и переносится с геля на плотный носитель (обычно нитроцеллюлозный фильтр или нейлоновую мембрану). Сам перенос (блоттинг) осуществляется за счет действия капиллярных сил, электрического поля или вакуума.
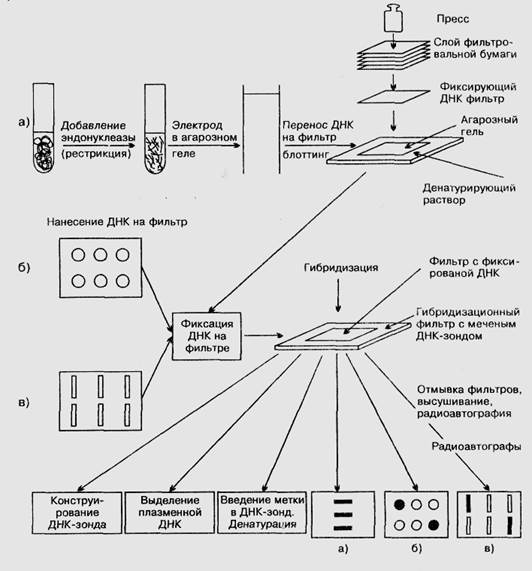
Рисунок 3. Гибридизация на фильтрах: а) блот-гибридизация по Саузерну, б) дот-гибридизация, в) слот-гибридизация.
Фиксированную на фильтре ДНК гибридизуют с радиоактивно меченым ДНК- или РНК-зондом. Методом авторадиографии определяют положение искомого фрагмента геномной ДНК на электрофореграмме. Блот-гибридизация - высоко чувствительный метод идентификации специфических последовательностей ДНК. При длительной экспозиции (в течение нескольких дней) и при высокой удельной радиоактивности ДНК-зонда (более 109 расп./(мин*мкг)) этот метод позволяет выявлять менее чем 0,1 пг ДНК. Так, при использовании зонда размерами в несколько сотен оснований уникальная последовательность в 1000 п.о. может быть выявлена в 10 мкг геномной рестрицированной ДНК в виде отдельной полосы на радиоавтографе после его экспозиции в течение 12 ч. Метод позволяет работать и с очень короткими олигонуклеотидными зондами (20 п.о.), однако требует особенно хорошего мечения и длительной экспозиции фильтра. Необходимость работы с чистыми препаратами ДНК, применение радиоактивных зондов, длительность и трудоемкость всей процедуры делают ее весьма дорогостоящей. Тем не менее, в ряде случаев и сегодня метод не потерял своего значения, в том числе и для диагностики генных болезней. В последнее время для этих целей нередко используют различные варианты нерадиоактивного мечения или окраску ДНК нитратом серебра.
Гибридизация с меченым ДНК-зондом препаратов ДНК или РНК, нанесенных капельно на твердый матрикс без предварительной рестрикции и электрофореза, носит название дот- или слот-гибридизации в зависимости от конфигурации пятна ДНК на фильтре - округлой или продолговатой, соответственно. На рис. 3 также изображены последовательные этапы этих методов.
Существуют также другие методы гибридизации ДНК-зондов. Гибридизация ДНК-зондов с электрофоретически разделенными молекулами РНК называется Нозерн-блот, а связывание электрофоретически разделенных белков, фиксированных на фильтрах, с мечеными антителами – носит название Вестерн-блот, или иммуноблот. Название этих методов - дань уважения молекулярных генетиков проф. Э. Саузерну, внесшему неоценимый вклад в разработку экспериментальных подходов, используемых для анализа ДНК. В ряде случаев для проведения гибридизации с ДНК-зондами не требуется предварительного выделения и очистки ДНК.
ГИБРИДИЗАЦИЯ IN SITU
Процедуру гибридизации можно проводить не только на геле, на фильтрах или в растворе, но и на гистологических или хромосомных препаратах. Этот метод носит название гибридизации in situ. Вариант метода, при котором в качестве зондов используют препараты ДНК или РНК, меченые флюорохромами, называется FISH - fluorescein in situ hybridization (флюоресцентная гибридизация in situ).
Меченый ДНК-зонд наносят на препараты дифференциально окрашенных и подготовленных для гибридизации (денатурированных) метафазных хромосом. Предварительная обработка хромосом направлена на облегчение доступа зонда к геномной ДНК.
Препараты фиксированных хромосом гибридизуют (инкубируют при повышенной температуре с последующим охлаждением) с исследуемыми последовательностями нуклеотидов, меченными радиоактивной, флуоресцентной или иной меткой. После отмывания несвязавшейся метки оставшиеся меченые молекулы нуклеиновых кислот оказываются ассоциированными с участками хромосом, содержащими последовательности, комплементарные исследуемым меченым последовательностям нуклеотидов. В качестве меток используется или светочувствительная эмульсия (радиоактивная метка), или биотин- или флюоресцеин-меченых ДНК-зонды.
Полученные гибриды анализируют с помощью микроскопа либо непосредственно, либо после авторадиографии. Для этой группы методов характерна высокая разрешающая способность, поскольку они позволяют локализовать изучаемые последовательности нуклеотидов на хромосомах (рис. 4, 5).
 а
а
 б
б
Рисунок 4. а- схема метода гибридизации in situ, б – результаты картирования хромосом человека методом FISH.
Гибридизация in situ позволяет определить, в каком сегменте хромосомы расположен соответствующий маркер. Флюоресцентная гибридизация in situ позволяет одновременно картировать несколько различно окрашенных маркеров ДНК. Эта методика особенно эффективна при исследовании распределения по геному повторяющихся последовательностей ДНК или клонированных последовательностей ДНК анонимного происхождения.
а 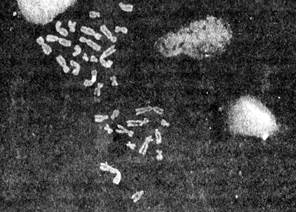 б
б 
Рис. 5. а-гибридизация in situ с биотинилированными ДНК-зондами. Цельнохромосомняя проба к 4-ой хромосоме; б - гибридизация in situ с биотинилированными ДНК-зондами. Прицентромерная проба к 18-ой хромосоме.
При проведении гибридизации в период интерфазы можно определить порядок маркеров в отдельных участках хромосомы, т.е. установить внутрихромосомную локализацию уникальных генов в тех случаях, когда имеются соответствующие ДНК-зонды. С помощью этого метода удается надежно выявить хромосомные аномалии.
Разрешающая способность метода может достигать нескольких хромосомных бэндов. Согласно последним данным, в экспериментах на специально приготовленных и растянутых интерфазных хромосомах человека разрешающая способность метода FISH может достигать 50 тыс. п.о., что составляет всего около 1/20 величины среднего хромосомного бэнда. Проблемы взаиморасположения клонированных фрагментов ДНК даже в пределах одного хромосомного локуса также с успехом решаются методом FISH.
Гибридизация in situ является одним из наиболее эффективных методов анализа тканеспецифического распределения и внутриклеточной локализации мРНК.
Вопросы для самоконтроля:
1. Какие химические вещества используются при проведении рестрикции?
2. Какова химическая природа и сколько видов рестриктаз известно?
3. В чем трудность составления рестрикционных карт у эукариот?
4. Как получают комплементарную ДНК?
5. Каких размеров получаются фрагменты-рестрикты?
6. Почему блот-гибридизацию можно использовать при изучение ДНК эукариот?
7. В каких случаях используется гибридизация in situ?
|
|
|


