 |
Порядок выполнения работы и обработки результатов измерений
|
|
|
|
Лабораторная работа № 53
ИЗУЧЕНИЕ СПЕКТРОВ ИЗЛУЧЕНИЯ АТОМОВ,
МОЛЕКУЛ И ТВЁРДЫХ ТЕЛ
Цель работы:
1. Ознакомиться с характером спектров излучения атомов химических элементов, молекул и твердых тел.
2. Изучить закономерности расположения спектральных серий и спектральных линий в спектре атома водорода.
3. Изучить устройство монохроматора УМ-2 и порядок работы с ним.
4. Снять спектры излучения различных газов и паров, молекул, а также твёрдых тел.
Теоретическое введение
 Оптическим спектром называется распределение по частотам (или длинам волн) интенсивности оптического излучения некоторого тела (спектр испускания) или интенсивности поглощения при его прохождении через вещество (спектр поглощения). Спектры делятся на три вида – линейчатые, полосатые и сплошные (рис.1, 2).
Оптическим спектром называется распределение по частотам (или длинам волн) интенсивности оптического излучения некоторого тела (спектр испускания) или интенсивности поглощения при его прохождении через вещество (спектр поглощения). Спектры делятся на три вида – линейчатые, полосатые и сплошные (рис.1, 2).
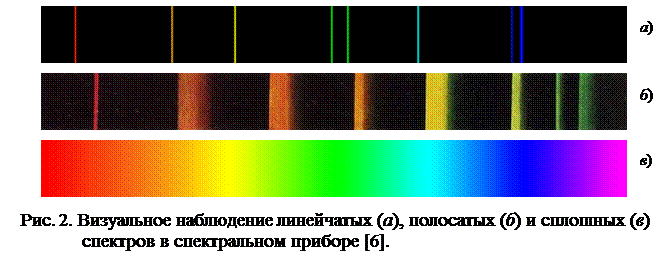
Линейчатые спектры излучают вещества в атомарном состоянии. Линейчатые спектры излучения выглядят как цветные линии, разделенные тёмными промежутками (рис. 1 а, 2 а). Атомы всех веществ излучают свойственные только им наборы волн вполне определенных частот.
Полосатые спектры излучаются молекулами. Выглядят полосатые спектры подобно линейчатым, только вместо отдельных линий наблюдаются отдельные серии линий, воспринимаемые как отдельные полосы (рис. 1 б, 2 б).
Сплошные спектры излучают вещества, находящиеся в твёрдом состоянии. Сплошной спектр содержит волны всех частот видимого света и поэтому выглядит как цветная полоса с плавным переходом от одного цвета к другому в следующем порядке: красный, оранжевый, желтый, зеленый, голубой, синий, фиолетовый (рис. 1 в, 2 в).
Задолго до создания квантовой теории атомов, в 1885 г., швейцарский физик И. Бальмер подобрал эмпирическую формулу, определяющую закономерность расположения спектральных линий атома водорода в видимой области:
|
|
|
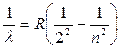
, (1)
где R - постоянная Ридберга, R = 1,1∙10 7 м -1 ,
n – целые числа, (n > 2), то есть n = 3, 4, 5,...
Это открытие послужило толчком для обнаружения других серий в спектре атома водорода – серии Лаймана в ультрафиолетовой области, серии Пашена в инфракрасной области и других. Физический смысл наблюдающихся закономерностей был установлен квантовой физикой.
Началом квантовой физики считается открытие квантования энергии, введённое нем. физиком Планком для объяснения характера спектра теплового излучения (рис. 1 в). Формула Планка энергии кванта
E = hν, (2)
где ν - частота испускаемого кванта света,
h - постоянная Планка; h = 6,63 ∙10 -34 Дж∙с,
является одной из основных в квантовой физике. Дальнейшее развитие квантовая физика получила в планетарной модели атома Резерфорда и в теории Бора, постулирующей дискретный характер энергии электрона в атоме (постулат стационарных орбит). Энергия h ν испущенного фотона в соответствии со вторым постулатом Бора равна разности энергий электрона в соответствующих состояниях:
h ν nk = En - Ek, (3)
где En, Ek - энергия электрона атома в состояниях n и k соответственно.
Именно этим и объясняется линейчатый характер спектров излучения атомов.
Из теории Бора выводится формула Бальмера для всех серий. При этом в формуле (1) вместо цифры 2 (номер серии Бальмера и соответственно номер уровня, на который электрон переходит с более высоких уровней) следует подставить целое число m (m = 1 - для серии Лаймана, 3 - для серии Пашена, 4 - для серии Брэкетта и т.д.). Таким образом, значение m устанавливает номер серии, а значения n – номера линий в серии. Далее, в теории Бора устанавливается, что постоянная Ридберга представляет собой комбинацию физических констант:
|
|
|
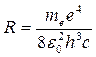
, (4)
где e - заряд электрона; e = 1,6∙10 -19 Кл,
m e - масса электрона; m e = 9,1∙10 -31 кг,
εо - электрическая постоянная; εо = 8,85∙10 -12 Ф/м.
 Это совпадение убедительно подтвердило правильность гипотезы Бора о квантовании энергии электрона в атоме. Следовательно, по теории Бора, количественно объяснившей спектр атома водорода, спектральные серии соответствуют излучению, возникающему в результате перехода атома в данное состояние из возбуждённых состояний, расположенных выше данного (рис. 3). Элементы резко отличаются друг от друга по сложности своего спектра. Например, в спектре лития наблюдается всего несколько десятков линий, а в спектрах вольфрама или железа известно около 5000 линий. Спектры атомов химических элементов приводятся в специальных атласах [5].
Это совпадение убедительно подтвердило правильность гипотезы Бора о квантовании энергии электрона в атоме. Следовательно, по теории Бора, количественно объяснившей спектр атома водорода, спектральные серии соответствуют излучению, возникающему в результате перехода атома в данное состояние из возбуждённых состояний, расположенных выше данного (рис. 3). Элементы резко отличаются друг от друга по сложности своего спектра. Например, в спектре лития наблюдается всего несколько десятков линий, а в спектрах вольфрама или железа известно около 5000 линий. Спектры атомов химических элементов приводятся в специальных атласах [5].
Молекулярные спектры значительно сложнее и многообразнее, чем атомные, так как строение молекулы более сложно, чем строение атома. У молекул имеют место ещё два вида движения, которых вообще нет в атомах. Это колебание отдельных атомов относительно положения равновесия и вращение всей молекулы вокруг оси подобно волчку. Оба эти движения приводят к появлению колебательных и вращательных уровней. Полная энергия изолированной молекулы
EΣ = Еэ + Ек + Евр, (5)
где Еэ – энергия движения электронов относительно ядер,
Ек – энергия колебательного движения атомов,
Евр – энергия вращательного движения молекулы.
При этом Еэ > Ек > Евр (рис. 4). Частоты спектральных линий, испускаемых молекулами, могут соответствовать переходам с одного электронного уровня на другой (электронные спектры) или с одного колебательного (вращательного) уровня на другой (колебательные (вращательные) спектры). Корме того, возможны комбинации этих переходов, дающие электронно-колебательные и колебательно-вращательные спектры. Поэтому спектр молекул весьма сложный и состоит из групп настолько тесно расположенных линий, что линии в группах сливаются в полосы (рис. 1 б, 2 б).
 На индивидуальности спектров атомов и молекул основан способ определения химического состава вещества методом изучения их спектров. Этот способ называется спектральным анализом.
На индивидуальности спектров атомов и молекул основан способ определения химического состава вещества методом изучения их спектров. Этот способ называется спектральным анализом.
Спектральный анализ открыли в 1860 г. немецкие физики Г. Кирхгоф и Р. Бунзен. Они установили, что спектр пламени газовой горелки зависит только от введённого металла, причём спектр каждого металла строго постоянен. Обнаружив в спектрах некоторых образцов новые незнакомые линии, они открыли новые химические элементы – рубидий (rubidus – красный) и цезий (ceasius – голубой). Позже другие исследователи открыли ещё четыре новые элемента: таллий, индий, галлий и гелий, причём гелий был впервые обнаружен при изучении спектра Солнца и только спустя четверть века был обнаружен на Земле.
|
|
|
Спектральный анализ широко применяется в науке и технике, например, для определения химического состава звезд, атмосферы планет, в геологии, химической, нефтеперерабатывающей, металлургической, машиностроительной, фармацевтической и других отраслях промышленности, в экологии для контроля объектов окружающей среды (воды, воздуха, почв). Чувствительность спектрального анализа очень высока – достигает 10-5 – 10-6 %. Для спектрального анализа характерна высокая избирательность. Это означает, что каждое вещество может быть определено качественно и количественно в образце сложного состава без его разделения на отдельные компоненты.
Атомный спектральный анализ определяет элементный состав образца по атомным (ионным) спектрам испускания и поглощения; молекулярный спектральный анализ определяет состав вещества по молекулярным спектрам поглощения, люминесценции и комбинационного рассеяния света.
 Разложение излучения источников света в спектр осуществляется с помощью специальных оптических приборов – спектральных аппаратов, в которых световые лучи с разными длинами волн отделяются в пространстве друг от друга. Спектральные аппараты устроены таким образом, что световые колебания каждой длины волны, попадающие в прибор, образуют одну линию. Сколько различных длин волн присутствовало в излучении источника света, столько линий получается в спектральном аппарате.
Разложение излучения источников света в спектр осуществляется с помощью специальных оптических приборов – спектральных аппаратов, в которых световые лучи с разными длинами волн отделяются в пространстве друг от друга. Спектральные аппараты устроены таким образом, что световые колебания каждой длины волны, попадающие в прибор, образуют одну линию. Сколько различных длин волн присутствовало в излучении источника света, столько линий получается в спектральном аппарате.
Современные спектральные приборы оснащены компьютерными базами данных, позволяющими значительно ускорить анализ содержания веществ по их спектрам (рис. 5). При этом на экран монитора выводятся спектр исследуемого вещества и наиболее близкие спектры нескольких веществ.
|
|
|
Описание установки
 Установка для наблюдения и измерения спектров в видимой области состоит из универсального монохроматора УМ-2, набора газоразрядных трубок, наполненных различными газами и блока питания к ним. Внешний вид и оптическая схема монохроматора приведены на рис. 6. Основные части монохроматора – коллиматор I, призменный столик с поворотным механизмом II и выходная труба III.
Установка для наблюдения и измерения спектров в видимой области состоит из универсального монохроматора УМ-2, набора газоразрядных трубок, наполненных различными газами и блока питания к ним. Внешний вид и оптическая схема монохроматора приведены на рис. 6. Основные части монохроматора – коллиматор I, призменный столик с поворотным механизмом II и выходная труба III.
Свет от источника 12 через входную щель 1 попадает на объектив 2 коллиматора и параллельным пучком проходит диспергирующую призму 3 (рис. 6 б). Под углом 90˚ к падающему пучку света помещается выходная труба монохроматора. Поворачивая призменный столик на различные углы относительно падающего пучка света, получают в выходной щели 5 свет различной длины волны.
В качестве входной щели коллиматора применена стандартная симметричная щель с шириной раскрытия от 0 до 4 мм, регулируемая барабанчиком 7 (рис. 6 а). Цена деления на барабанчике равна 0,01 мм. Ножи входной щели установлены в фокальной плоскости объектива 2 коллиматора. Фокусировка объектива производится маховичком 9. В трубе коллиматора между щелью и объективом помещён затвор, с помощью которого можно прекратить доступ света в прибор. Движением затвора управляют с помощью рукоятки 8.
В качестве диспергирующего элемента используется призма Аббе 3. Эта призма включает две прямоугольные призмы с преломляющими углами α 1 = 30˚, разлагающие свет в спектр. Призмы приклеены к граням равнобедренной (с α 2 = 45˚) прямоугольной призмы полного внутреннего отражения. Показатели преломления всех призм одинаковы (n1 = n2). В призме Аббе разложение света в
 |
спектр сопровождается отклонением пучка лучей на 90˚.
Поворот призмы производится с помощью барабана длин волн 10. На барабане нанесены относительные деления – градусы. Отсчёт читается против указателя, скользящего по спиральной канавке (рис. 7 а). Рабочий диапазон длин волн монохроматора УМ-2 λ = (3800 ÷ 10000) Å. (1 Å = 1∙10-10 м).
Лучи света, пройдя диспергирующую призму, попадают в объектив 4 (рис. 6 а) выходной трубы монохроматора, который собирает их в плоскости выходной щели 5. В фокальной плоскости окуляра 6 зрительной трубы имеется указатель, освещаемый лампочкой через сменные светофильтры в револьверной оправе 11.
Визуальное наблюдение спектральных линий осуществляется через окуляр с визиром. Для определения длины волны спектральных линий необходимо с помощью барабана совместить линию с визиром и снять отсчет на барабане. Затем, используя градуировочный график (рис. 7 б), перевести показание барабана в длину волны.
|
|
|
Примечание: Градуировочный график рис. 7б носит ознакомительный характер. Рабочие графики размещены на стендах монохроматоров.
Порядок выполнения работы и обработки результатов измерений
1. Ознакомиться с устройством и работой монохроматора УМ-2.
2. Установить перед коллиматором I монохроматора источник света с ртутной лампой. Произвести настройку монохроматора по двум оранжевым линиям (5770 Å и 5790 Å) таким образом, чтобы они были видны раздельно и резко.
Примечание. Настройка монохроматора производится лаборантом или преподавателем.
3. Снять наиболее интенсивные линии, наблюдающиеся в спектре паров ртути. Данные занести в таблицу 1. Интенсивность линий оценивать качественно по пятибалльной шкале - очень сильная (о. с.), сильная (с.), средняя (ср.), слабая (сл.) и очень слабая (о. сл).
Таблица 1 [5]
| Пары ртути | Газ - гелий | ||||||||||
| Эксперимент | Справочн. | Эксперимент | Справочн. | ||||||||
| Деления барабана | λ, Å | Интенсивность | Цвет | λ, Å | Интен-сивность | Деления барабана | λ, Å | Интенсивность | Цвет | λ, Å | Интен-сивность |
Примечание. Справочные значения интенсивности линий в таблицах 1, 2 указаны в относительных единицах. Жирным шрифтом выделены наиболее сильные линии в спектрах. Для неона указаны только наиболее сильные линии.
Таблица 2 [5]
| Газ - неон | Газ – неон (продолжение) | ||||||||||
| Эксперимент | Справочн. | Эксперимент | Справочн. | ||||||||
| Деления барабана | λ, Å | Интенсивность | Цвет | λ, Å | Интен-сивность | Деления барабана | λ, Å | Интенсивность | Цвет | λ, Å | Интен-сивность |
4. Произвести аналогичные измерения для других газов (гелий, неон – по указанию преподавателя). Данные занести в таблицы (1, 2).
5. Установить перед объективом монохроматора лампу накаливания и ознакомиться с характером спектра нагретого твердого тела. Измерить длину волны, соответствующей середине λср каждой области спектра (красной, оранжевой, желтой, зеленой и т.д.). Данные занести в таблицу 3.
Таблица 3
| Цвет | Красный | Оранжевый | Жёлтый | Зелёный | Голубой | Синий | Фиолетовый |
| λср, мкм |
6. Установить перед объективом монохроматора источник света с ртутной лампой. Закрыть окно лампы ультрафиолетовым светофильтром. Установить кювету с органической жидкостью. Наблюдать спектр люминесценции молекулярного вещества. Данные о середине полосы λср и её ширине Δλ занести в таблицу 4.
Таблица 4
| Цвет | ||||
| λср, мкм | ||||
| Δλ, мкм |
На основании полученных данных необходимо провести качественный анализ состава газа в газоразрядных трубках. Химический состав газов в газоразрядных трубках подтверждают, сопоставляя измеренные в работе длины волн с табличными данными спектральных линий элементов (источники света надписаны). Качественный анализ производится, как правило, по наиболее сильным линиям спектров.
Сделать выводы о характере спектров газов, паров, органических жидкостей и твёрдых тел.
Контрольные вопросы
1. Дать определение понятия «спектр».
2. Перечислить виды спектров и указать их характер.
3. Чем обусловлен линейчатый характер спектров излучения атомов?
4. Чем обусловлен полосатый характер спектра поглощения молекул?
5. На чем основана возможность определения химического состава вещества
с помощью спектрального анализа?
6. Формула Бальмера для спектра атома водорода. Постоянная Ридберга. Опре-
деляющие ее константы.
7. Дать определение явления дисперсии света. Указать и объяснить порядок сле-
дования цветов в дисперсионном спектре призмы.
8. Устройство и работа монохроматора УМ-2.
9. Перечислить области применения спектрального анализа.
Список рекомендуемой литературы
1. Трофимова Т.И. Курс физики: Учеб. пособие для вузов. - 7-е изд., стер. - М.: Высшая школа, 2003.- §§ 209, 210, 212.
2. Детлаф А.А., Яворский Б.М. Курс физики: Учеб. пособие для втузов.- 2-е изд., испр. И доп. М.: Высшая школа, 1999.- §§ 38.3, 38.4.
3. Савельев И.В. Курс физики: Учеб.: В 3-х т. Т. 3. Квантовая оптика. Атомная физика. Физика твердого тела. Физика атомного ядра и элементарных частиц. - М.: Наука., 1987. - §§ 22, 29.
4. Грабовский Р.И. Курс физики. - М.: Высшая школа, 1980. - Часть II, §§ 63, 64.
5. А.Н. Зайдель, В.К. Прокофьев, С. М. Райский. Таблицы спектральных линий. – М. – Л.: ГИТТЛ., 1952. 560 с.
6. Физический энциклопедический словарь. / Гл. ред. А.М. Прохоров. Ред. кол. Д.М. Алексеев, А.М. Бонч-Бруевич, А.С. Боровик-Романов и др. – М.: Сов. Энциклопедия, 1984. Атомные спектры с. 41- 42. Молекулярные спектры с. 435 – 437. Спектральные призмы с. 707 – 708. Спектральный анализ с. 708 – 710. Спектры оптические с. 712 – 713. Люминесцентный анализ с. 353 – 354.
7. http://www.bioscorp.ru/ Спектрометр атомно-абсорбционный МГА 915.
|
|
|


