 |
Методы культивирования и индикации вирусов
|
|
|
|
Культивирование вирусов в организме лабораторных животных. Выбор экспериментальных животных определяется целью работы и видовой чувствительностью к изучаемому вирусу. Для заражения используют обезьян, кроликов, морских свинок, хомячков, белых крыс и мышей.
Лабораторных животных заражают различными способами в зависимости от тропизма вируса к определенным тканям. Так, например, для культивирования нейротропных вирусов заражение производят преимущественно в мозг (вирусы бешенства, клещевого энцефалита и др.), культивирование респираторных вирусов осуществляется при интраназальном инфицировании животных (вирусы гриппа), дерматотропных (вирус оспы) – путем накожного и внутрикожного заражения. Наиболее часто используются накожное, внутрикожное, внутримышечное, внутрибрюшинное и внутримозговое заражение.
При первичном заражении животные могут не заболеть, поэтому через 5–7 дней внешне здоровых животных убивают, а из их органов готовят суспензии, которыми заражают следующие партии животных. Эти последовательные заражения называются «пассажами».
Индикацию, т.е. обнаружение факта размножения вируса, устанавливают на основании развития типичных признаков заболевания, патоморфологических изменений органов и тканей животных или положительной реакции гемагглютинации (РГА). РГА основана на способности некоторых вирусов вызывать агглютинацию (склеивание) эритроцитов различных видов животных, птиц и человека за счет поверхностного вирусного белка – гемагглютинина.
В настоящее время использование животных для культивирования вирусов ограничено.
Культивирование вирусов в куриных эмбрионах. Большинство известных вирусов обладают способностью размножаться в курином эмбрионе (рис.56). Используют эмбрионы в возрасте от 8 до 14 дней в зависимости от вида вируса, способа заражения и задач исследования. Вирусы гриппа культивируются в 9–10-, осповакцины – в 12-, паротита – в 7-дневных куриных эмбрионах. Размножение вируса в куриных эмбрионах происходит в разных частях зародыша, что связано с особенностями тропизма вируса. Методику выращивания вируса в курином эмбрионе широко используют при промышленном культивировании.
|
|
|

Рис. 56. Строение куриного эмбриона и способы его заражения: 1 – в амнион; 2 – в аллантоисную полость; 3 – в желточный мешок. (Микробиология и иммунология. Под редакцией Воробьева А.А. – М. – 1999).
Существует несколько способов заражения развивающегося куриного эмбриона: на хорионаллантоисную оболочку, в аллантоисную и амниотическую полости, желточный мешок, тело эмбриона.
Заражение на хорионаллантоисную оболочку применяется для выделения и культивирования вирусов, образующих на оболочках бляшки (вирусы вакцины, натуральной оспы, простого герпеса). Перед заражением яйца просвечивают с помощью овоскопа, карандашом очерчивают границу воздушного пространства и хорионаллантоисной оболочки. Поверхность яйца над воздушным пространством и в месте заражения протирают спиртом, прожигают, обрабатывают йодом и делают отверстие в полости воздушного мешка. На месте заражения скорлупу удаляют так, чтобы не повредить подскорлупную оболочку, которую затем прокалывают короткой стерильной иглой, чтобы не повредить хорионаллантоисную оболочку. Воздух из полости воздушного мешка отсасывают. Вирусный материал (0,05–0,2 мл) наносят на хорионаллантоисную оболочку туберкулиновым шприцем с короткой иглой или пастеровской пипеткой. Отверстие в скорлупе закрывают стерильным покровным стеклом или тем же выпиленным кусочком скорлупы и по краям заливают расплавленным парафином. Зараженные эмбрионы располагают на подставке горизонтально и инкубируют в термостате. Вскрытие эмбрионов производится не раньше 48 ч инкубации. На зараженной оболочке обнаруживаются беловатые непрозрачные пятна разной формы (бляшки).
|
|
|
Заражение в аллантоисную полость. Вирус, введенный в аллантоис, размножается в эндодермальных клетках, переходя затем в аллантоисную жидкость. Заражение осуществляют следующим способом: в скорлупе над воздушной камерой острием скальпеля или ножниц производят прокол, после чего через отверстие в вертикальном направлении вводят иглу со шприцем, которая проходит через хорионаллантоисную оболочку и попадает в аллантоисную полость, материал вводится в объеме 0,1 мл и отверстие заливают парафином.
Заражение в желточный мешок. С этой целью используют эмбрионы 5–10-дневного возраста. Наиболее употребительны два метода заражения. По первому материал вводится через воздушное пространство. В центре яйца делают отверстие, помещают его на подставку тупым концом вправо и через отверстие в вертикальном направлении вводят иглу, надетую на шприц, игла проходит через хорионаллантоисную оболочку, аллантоисную полость в желток. В желточный мешок можно ввести от 0,1 до 0,5 мл вируссодержащего материала. После заражения отверстие в скорлупе заливают парафином, и эмбрион помещают в термостат. По второму методу на границе воздушного пространства с той стороны, где лежит желток (стороны, противоположной от эмбриона), делают прокол скорлупы, через который вводят инфекционный материал. Направление иглы должно быть к центру яйца.
Индикацию вирусов в курином эмбрионе осуществляют на основании специфических поражений оболочек и тела эмбриона (оспины, кровоизлияния), а также в РГА.
Культивирование вирусов в культуре клеток. Клетки, полученные из различных органов и тканей человека, животных, птиц или других биологических объектов, способны размножаться вне организма на искусственных питательных средах в специальной лабораторной посуде («матрасы», флаконы, пробирки и др.). Большое распространение получили культуры клеток из эмбриональных и злокачественно перерожденных тканей, обладающих более активной по сравнению с нормальными клетками взрослого организма способностью к росту и размножению. В зависимости от техники приготовления различают три вида культур клеток:
|
|
|
1. однослойные – клетки, способные прикрепляться и размножаться на поверхности химически нейтрального стекла лабораторной посуды в виде монослоя;
2. суспензионные – клетки, размножающиеся во всем объеме питательной среды при постоянном ее перемешивании;
3. органные – цельные кусочки органов и тканей, сохраняющие исходную структуру вне организма (применяются ограничено).
По числу жизнеспособных генераций культуры клеток подразделяются на:
1. первичные, способные размножаться только на первых генерациях, т.е. в нескольких пассажах после выделения из тканей;
2. перевиваемые, или стабильные, способные размножаться в лабораторных условиях неопределенно длительный срок посредством постоянного пассирования;
3. полуперевиваемые, имеющие ограниченную продолжительность жизни (40-50 пассажей).
Приготовление первичной культуры клеток складывается из нескольких последовательных этапов: измельчение ткани, разъединение клеток путем трипсинизации, отмывание полученной однородной суспензии изолированных клеток от трипсина с последующем суспендированием клеток в питательной среде.
Перевиваемые однослойные культуры клеток приготавливают из злокачественных или нормальных линий клеток, обладающих способностью длительно размножаться in vitro в определенных условиях. К ним относятся злокачественные клетки HeLa, первоначально выделенные из карциномы шейки матки, Hep-3 (из лимфоидной карциномы), а также нормальные клетки амниона человека, почек обезьян и др.
|
| ||||
а б
Рис. 57. Индикация репродукции вируса в культуре ткани по цитопатическому действию (ЦПД): а – интактная монослойная культура клеток, б – зараженная культура (ЦПД). (Микробиология и иммунология.-Под ред. А.А. Воробьева.-М, Медицина, 1999.-464 с.)
К полуперевиваемым культурам относятся диплоидные клетки человека. Они представляют собой клеточную систему, сохраняющую в процессе 50 пассажей (до года) диплоидный набор хромосом. Диплоидные клетки человека не претерпевают злокачественного перерождения и этим выгодно отличаются от опухолевых.
|
|
|
Для выращивания вирусов можно использовать культуры тканей любого типа. Доза заражения зависит от цели и назначения опыта. Тканевые культуры используют для выделения новых малоизученных вирусов, когда обычным методом (заражение животных, куриных эмбрионов) невозможно установить вирусную природу возбудителя. Выбор клеточных культур определяется их чувствительностью к отдельным группам вирусов.
Различают острую и хроническую инфекции. Острое течение инфекции характеризуется цитопатическим действием (деструктивными изменениями зараженных клеток, завершающихся их гибелью). Хроническая форма репродукции вируса не вызывает быструю гибель клеток, они долгое время остаются жизнеспособными и внешне могут не отличаться от зараженных.
Индикацию вирусов в культуре клеток проводят на основании следующих феноменов:
1. Цитопатическое действие (ЦПД) – видимые под микроскопом морфологические изменения клеток, вплоть до их отторжения от стекла, которые возникают в результате внутриклеточной репродукции вирусов (рис. 57). Характер ЦПД при различных вирусных инфекциях неодинаков. При репродукции одних вирусов (парамиксовирусы, герпесвирусы) наблюдается слияние клеток с образованием синцития, других (энтеровирусы, реовирусы) – сморщивание и деструкция клеток, третьих (аденовирусы) – агрегация клеток и т.д.
2. Вирусные включения – скопление вирусных частиц или отдельных компонентов вирусов в цитоплазме или ядре клеток, выявляемые под микроскопом при специальном окрашивании. Включения различаются по величине, форме, численности. Характерные ядерные включения формируются в клетках, зараженных вирусами герпеса, аденовирусами, гриппа, бешенства, оспы и др.
3. Бляшки, или негативные колонии – ограниченные участки, состоящие из дегенеративных клеток, которые вирусы способны образовывать в монослое клеток под агаровым покрытием. Они видны невооруженным глазом как светлые пятна на фоне прижизненно окрашенных нейтральным красным клеток. Одна бляшка соответствует потомству одного вириона. Негативные колонии разных вирусов отличаются по размеру, форме. Бляшкообразование используют для дифференциации, селекции вирусов, а также для определения их концентрации в исследуемом материале. Титр вируса, установленный этим методом, выражают числом бляшкообразующих единиц (БОЕ) в 1 мл.
|
|
|
4. «Цветная» проба. Если вирусы не размножаются в культуре клеток, то живые клетки в процессе своего метаболизма выделяют кислые продукты, что ведет к изменению рН среды и цвета индикатора фенолового красного на желтый. При продукции вирусов нормальный метаболизм клеток нарушается, клетки гибнут, и среда сохраняет свой первоначальный (красный) цвет. Таким образом, красный цвет среды указывает на наличие вируса и прекращение жизнедеятельности клеток.
5. Гемадсорбция – способность культур клеток, инфицированных вирусами, адсорбировать на своей поверхности эритроциты определенных видов животных и птиц. Гемадсорбция проявляется скоплением в виде гроздей эритроцитов, адсорбированных на инфицированных вирусом клетках.
6. Интерференция – некоторые вирусы можно обнаружить в культуре ткани только по наличию интерференции. Испытуемый вирус вводится в культуру клеток первым, через несколько дней туда же вносят стандартную дозу вируса, обладающего выраженной цитопатической активностью или способностью вызывать гемадсорбцию. После определенного инкубирования проверяют наличие цитопатических изменений или гемадсорбции, подтверждающих размножение «выявляющего» вируса. Отсутствие в культуре «выявляющего» вируса говорит о наличии испытуемого вируса.
Генетика вирусов
Вирусам, как и всем живым организмам, свойственны наследственность и изменчивость. Основной особенностью вирусного генома является то, что наследственная информация у вирусов может быть записана как на ДНК, так и на РНК. Геном ДНК-содержащих вирусов двухнитевой (исключение составляют парвовирусы, имеющие однонитевую ДНК), несегментированный и проявляет инфекционные свойства. У вирусов, принадлежащих к родам Poxvirus и Hepadnavirus геном представлен двумя цепочками ДНК разной длины. Геном большинства РНК-содержащих вирусов однонитевой (исключение составляют реовирусы и ретровирусы, обладающие двунитевыми геномами) и может быть сегментированным (представители родов Retrovirus, Orthomyxovirus, Arenavirus и Reovirus) или несегментированным.
Вирусные РНК в зависимости от выполняемых функций подразделяются на две группы. К первой группе относятся РНК, способные непосредственно транслировать генетическую информацию на рибосомы чувствительной клетки, т.е выполнять функции иРНК и мРНК. Их называют плюс-нити РНК и обозначают как +РНК (позитивный геном). Они имеют характерные окончания («шапочки») для специфического распознавания рибосом.
У другой группы вирусов РНК не способна транслировать генетическую информацию непосредственно на рибосомы и функционировать как иРНК. Такие РНК служат матрицей для образования иРНК, т.е. при репликации первоначально синтезируется матрица (+РНК) для синтеза –РНК. Такой тип РНК определяют как минус-нить и обозначают –РНК (негативный геном). У вирусов этой группы репликация РНК отличается от транскрипции по длине образующихся молекул: при репликации длина РНК соответствует материнской нити, а при транскрипции образуются укороченные молекулы иРНК. Молекулы +РНК проявляют инфекционность, а –РНК не проявляют инфекционные свойства и для воспроизведения должны транскрибироваться в +РНК.
Исключение составляют ретровирусы, которые содержат однонитевую +РНК, служащую матрицей для вирусной РНК-зависимой ДНК-полимеразы (обратной транскриптазы). При помощи этого фермента информация переписывается с РНК на ДНК, в результате чего образуется ДНК-провирус, интегрирующий в клеточный геном.
Так же как и у прочих форм жизни нуклеиновые кислоты вирусов подвержены мутациям. Фенотипически мутации вирусного генома проявляются изменениями в антигенной структуре, неспособности вызывать продуктивную инфекцию в чувствительной клетке, термостабильностью, изменением размера и формы бляшек, образуемых под агаровым покрытием. Большинству мутаций присущи реверсии к дикому типу, причем каждая мутация имеет характерную частоту реверсий, которую можно точно измерить. У вирусов выделяют спонтанные и индуцированные мутации.
Скорость спонтанного мутагенеза в ДНК-геномах значительно ниже (10-8 – 10-11 на каждый включенный нуклеотид), чем у РНК-геномных (10-3 – 10-4 на каждый включенный нуклеотид). Более высокая частота спонтанных мутаций связана с низкой точностью репликации РНК-геномов, которая вероятно связана с отсутствием у РНК-репликаз корректирующей активности, свойственной ферментам, реплицирующим ДНК. Наиболее часто спонтанные мутации наблюдаются у ретровирусов, что связано с более высокой частотой сбоев в обратной транскрипции, не способных к самокоррекции.
Индуцированные мутации у вирусов получают при действии различных химических и физических мутагенов, которые подразделяют на действующие in vivo и in vitro.
Вирусные мутации классифицируют по изменениям фенотипа и генотипа. По фенотипическим проявлениям мутации вирусов разделяют на четыре группы:
1. Мутации, не имеющие фенотипического проявления.
2. Летальные мутации, т.е. полностью нарушающие синтез или функцию жизненно важных белков и приводящие к утрате способности к репродукции.
3. Условно летальные мутации, т.е. мутации с потерей способности синтезировать определенный белок или с нарушением его функции только в определенных условиях.
4. Мутации, имеющие фенотипическое проявление, например изменение размеров бляшек под агаровым покрытием или термостабильности.
По изменению генотипа мутации подразделяют на точечные (локализующиеся в индивидуальных генах) и генные (затрагивающие более обширные участки генома).
Заражение вирусами чувствительных клеток носит множественный характер, т.е. в клетку проникает сразу несколько вирионов. При этом вирусные геномы в процессе репликации могут кооперироваться или интерферировать. Кооперативные взаимодействия между вирусами представлены генетическими рекомбинациями, генетической реактивацией, комплементацией и фенотипическим смешиванием.
Генетическая рекомбинация чаще встречается у ДНК-содержащих вирусов или РНК-содержащих вирусов с фрагментированным геномом (вирус гриппа). При генетической рекомбинации происходит обмен между гомологичными участками вирусных геномов.
Генетическая реактивация наблюдается между геномами родственных вирусов с мутациями в разных генах. При перераспределении генетического материала формируется полноценный геном.
Комплементация происходит когда один из вирусов, инфицирующих клетку, в результате мутации синтезирует нефункциональный белок. Немутантный вирус, синтезируя полноценный белок, восполняет отсутствие его у мутантного вируса.
Фенотипическое смешивание происходит при смешанном заражении чувствительной клетки двумя вирусами, когда часть потомства приобретает фенотипические признаки, присущие двум вирусам, при неизменном генотипе.
При множественном инфицировании чувствительной клетки между вирусами могут возникать интерферирующие взаимодействия. Интерфернцией вирусов называют состояние невосприимчивости к вторичному заражению клетки, уже инфицированной вирусом. При гетерологической интерференции инфицирование одним вирусом полностью блокирует возможность репликации второго вируса в пределах одной клетки. Механизмы гетерологической интерференции связаны с угнетением адсорбции другого вируса путем блокирования или разрушения специфических рецепторов, а так же с ингибированием трансляции мРНК любой гетерологичной мРНК в инфицированной клетке. Кроме того, первичное заражение может индуцировать образование интерферона, ингибирующего репликацию второго вируса.
Гомологическая интерференция, т.е. интерференция между гомологичными вирусами, характерна для многих вирусов, особенно при повторных пассажах in vitro и при высокой множественности инфицирования. В таких условиях образуется много дефектных вирусных частиц, обычно не способных к репродукции. Однако размножение дефектных вирусов возможно при совместном заражении с полноценным вирусом (вирус-помощник). При этом дефектный вирус может вмешиваться в репликативный цикл вируса-помощника и образовывать дочерние дефектные интерферирующие (ДИ) вирусные частицы. ДИ-частицам присущи три основных свойства: дефектность (повреждение в важных генах), способность к интерференции (ДИ-частицы препятствуют репликации полноценного вируса или других гомологичных вирусов) и способность к самообогащению за счет стандартного вируса. Циркуляция ДИ-частиц и коинфекция с полноценным вирусом вызывают вялотекущие, длительные формы инфекции.
Кроме взаимодействий, происходящих между вирусами, при смешанной инфекции происходят также взаимодействие между вирусом и клеткой-хозяином. При взаимодействии клеток с ДНК-содержащими вирусами может происходить вирусная трансформация клетки. В результате трансформации у клеток изменяются морфологические, биохимические и ростовые характеристики, может появляться способность к опухолевому росту. Представляет интерес трансформация клеток под действием РНК-геномных ретровирусов. У ретровирусов трансформация и репликация не являются взаимоисключающими, поскольку трансформированные клетки способны реплицировать вирус. Геномы трансформирующих вирусов обычно интегрируют с геномом трансформируемой клетки.
Противовирусный иммунитет
Особенности противовирусного иммунитета обусловлены своеобразием анатомического строения вирусов, сравнительно небольшим набором антигенов их оболочек, возможностью дрейфа поверхностных антигенов (белков), абсолютным паразитизмом вирусов, особенностью их взаимодействия с чувствительными клетками.
В макроорганизме вирус может находиться в различных состояниях:
a) внеклеточно (вирион);
b) внутриклеточно, на разных стадиях быстрого или медленного продуктивного взаимодействия с чувствительной клеткой (вирус);
c) быть интегрированным в геном клетки-мишени (непродуктивное взаимодействие, провирус).
Соответственно этим основным состояниям вируса формирующийся противовирусный иммунитет направлен на нейтрализацию и удаление вируса и его антигенов из организма, что достигается с помощью антител, а также на уничтожение собственных инфицированных вирусом клеток-мишеней цитотоксическими Т-лимфоцитами (Тс).
Образующиеся при вирусных инфекциях антитела IgG могут участвовать в разных биологических реакциях.
1. Нейтрализация инвазивных свойств вирионов. Образовавшийся комплекс связывается с поверхностью макрофага за счет его Fc-рецепторов. Поглощение комплекса обычно ведет к гибели возбудителя (рис. 58), непоглощенные иммунные комплексы могут диссоциировать, а освободившиеся вирионы заражают чувствительные клетки. Длительная циркуляция непоглощенных и недиссоциированных иммунных комплексов по всему организму может приводить к депонированию их в различных тканях организма и индуцировать развитие местных воспалительных реакций через активацию системы комплемента или интерлейкинов после фиксации комплекса клетками, имеющими рецептор к Fc-фрагменту антител (гепатит В, инфекционный мононуклеоз, подострый склерозирующий панэнцефалит и др.).
2. Антителоопосредованный комплемент-зависимый цитолиз зараженных вирусом клеток-мишеней представлен на рис. 58. Лизис мембраны зараженной клетки происходит за счет мембраноатакующего комплекса (МАК) комплемента. Освободившиеся вирионы подвергаются воздействию антител.
3. Антителоопосредованный цитолиз клеток-мишеней макрофагами и гранулоцитами при выделении ими в момент контакта с пораженной клеткой гранзимов и цитолизинов (рис. 58). Такие макрофаги и гранулоциты должны иметь Fc-рецепторы. Специфичностью по отношению к вирусному антигену они не обладают. Цитотоксические Т-лимфоциты в этой реакции не участвуют. Их активность от наличия антител не зависит. Разрушение пораженных вирусом клеток осуществляется также цитотоксическими Т-лимфоцитами Тс (рис. 59). Тс способны лизировать инфицированные вирусом клетки, реагируя на вирусный антиген представленный клеткой на ГКГС-I.
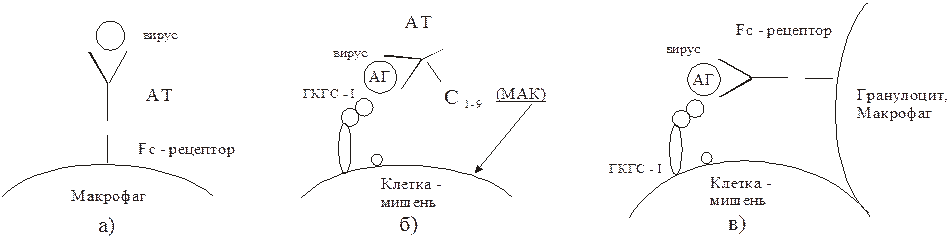 |
Рис. 58. Участие АТ в противовирусном иммунитете
а) Нейтрализация антителами свободных вирионов.
б) Антителопосредованный комплиментзависимый цитоз клетки – мишени.
в) Антителопосредованный цитоз гранулоцитами.
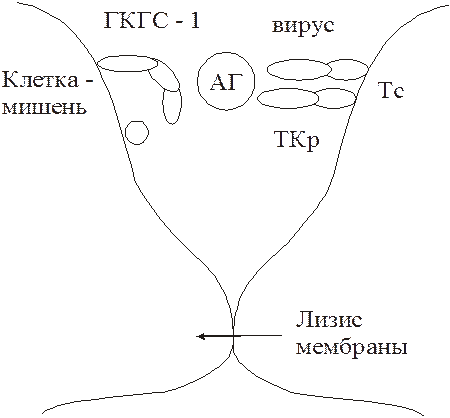 |
Для цитотоксического действия Тс-лимфоцитам необходим непосредственный контакт с клеткой-мишенью. После этого происходит выделение Тс-лимфоцитом гранзимов или цитолизинов, вызывающих изменение мембранной проницаемости клетки-мишени. Ее осмотическое набухание, разрыв мембраны и выход содержимого цитоплазмы в микроокружающую среду.
Рис. 59. Взаимодействие цитотоксического
Т-лимфоцита с клеткой – мишенью.
Способностью к интеграции вирусной нуклеиновой кислоты в геном клетки-мишени обладают ДНК-содержащие вирусы и ретровирусы. Потомство зараженной клетки наследует провирус. Вирусные антигены (белки) в клетке не синтезируются, они не представлены на ГКГС-I. Иммунному надзору такая клетка не поддается.
ОСНОВНАЯ ЛИТЕРАТУРА
1. Авакян А.А., Быковский А.Ф. Атлас анатомии и онтогенеза вирусов человека и животных. М., 1970.
2. Бережная Н.М., Бобкова Л.П., Петровская И.А., Ялкут С.И. Аллергология. – Киев. – 1986. – 445с.
3. Вирусология. Под ред. Б. Филдса и Д. Найпа. – т. 1. – М. «Мир», 1989. – 494с.
4. Генис Д.В. Медицинская паразитология. М., Медицина. – 1991. – 240с.
5. Гусев М.В., Минеева Л.А. Микробиология. М., МГУ. – 1994. – 294с.
6. Джавец Э., Мелькик Дж. Л., Эйдельберт Э.А. Руководство по медицинской микробиологии. М., 1982, Т.1. – 264с.
7. Западнюк И.П., Западнюк В.И., Захарня Е.А. Лабораторные животные. – Киев. – 1983. – 292с.
8. Кашкин П.Н., Лисин В.В. Практическое руководство по медицинской микологии. М., 1983. – 185с.
9. Коротяев А.И., Бабичев С.А. Медицинская микробиология с иммунологией и вирусологией. С.-Петербург, 1998. -–592с.
10. Льюин Б. Гены. – Мир, 1987. – 544с.
11. Маянский А.Н. Микробиология для врачей. Издательство НГМА, Нижний Новгород, 1999. – 450с.
12. Медицинская микробиология. Под ред. В.И. Покровского и О.Е. Поздеева. М.- «Геотар медицина» - 1998. – 1184с.
13. Микробиология и иммунология. Под ред. А.А. Воробьева. М. – «Медицина» - 1999. – 464с.
14. Плейфер Дж. Наглядная иммунология. М. – ГЭОТАР Медицина. – 1999. – 96с.
15. Шлегель Г. Общая микробиология. – М., Мир. – 1987. – 566с.
|
|
|




