 |
Химические свойства оксидов и оснований
|
|
|
|
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
Электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра физической химии
отчет
По лабораторным работам № 1, 2
По дисциплине «Химия»
Тема: Химические свойства оксидов и оснований.
Получение кислот, солей и изучение их химических свойств
| Студентка гр. 6181 | Федорова Д.А. | |
| Преподаватель | Завьялова А.Ю. |
Санкт-Петербург
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ И ОСНОВАНИЙ
Цели работы: ознакомление с методами получения оксидов и оснований и изучение их химических свойств.
Оксиды – химические соединения, состоящие из двух элементов, один из которых кислород в степени окисления «-2».
Оксиды делятся на солеобразующие и несолеобразующие. Последних довольно мало ( ,
,  ,
,  ), они не образуют солей ни с кислотами, ни со щелочами. Солеобразующие оксиды делятся на основные, кислотные и амфотерные.
), они не образуют солей ни с кислотами, ни со щелочами. Солеобразующие оксиды делятся на основные, кислотные и амфотерные.
Основными называются оксиды ( ,
,  и др.), которым соответствуют гидроксиды, относящиеся к классу оснований. Реагируя с кислотами, они образуют соль и воду. Основные оксиды – это оксиды металлов. Для них характерен ионный тип химической связи. У металлов, входящих в состав основных оксидов, степень окисления, как правило, бывает не выше +3.
и др.), которым соответствуют гидроксиды, относящиеся к классу оснований. Реагируя с кислотами, они образуют соль и воду. Основные оксиды – это оксиды металлов. Для них характерен ионный тип химической связи. У металлов, входящих в состав основных оксидов, степень окисления, как правило, бывает не выше +3.
Кислотными называют оксиды ( и др.), которым соответствуют гидроксиды, относящиеся к классу кислот. Реагируя с основаниями, эти оксиды образуют соль и воду. Кислотные оксиды – это, главным образом, оксиды неметаллов с ковалентной связью. Степень окисления металлов в кислотных оксидах, как правило, больше +4 (
и др.), которым соответствуют гидроксиды, относящиеся к классу кислот. Реагируя с основаниями, эти оксиды образуют соль и воду. Кислотные оксиды – это, главным образом, оксиды неметаллов с ковалентной связью. Степень окисления металлов в кислотных оксидах, как правило, больше +4 ( ).
).
Амфотерными называются оксиды ( ,
,  и др.), которые обладают двойственными свойствами и ведут себя в одних условиях как основные, а в других – как кислотные, т. е. образуют соли при взаимодействии как с кислотами, так и с основаниями.
и др.), которые обладают двойственными свойствами и ведут себя в одних условиях как основные, а в других – как кислотные, т. е. образуют соли при взаимодействии как с кислотами, так и с основаниями.
|
|
|
Многие элементы проявляют переменную степень окисления, образуют оксиды различного состава, что учитывается при названии оксида указанием 4 валентности элемента, например:  – оксид хрома (II), валентности элемента, например:
– оксид хрома (II), валентности элемента, например:  – оксид хрома (II),
– оксид хрома (II),  - оксид хрома (III),
- оксид хрома (III),  - оксид хрома (VI).
- оксид хрома (VI).
Существуют соединения элементов с кислородом, которые по составу относятся к классу оксидов, но по своему строению и свойствам принадлежат к классу солей. Это так называемые пероксиды или перекиси. Обычно их рассматривают как соли слабой кислоты (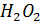 ), например
), например 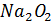 . Характерной особенностью строения этих соединений является наличие в их структуре двух связанных между собой атомов кислорода
. Характерной особенностью строения этих соединений является наличие в их структуре двух связанных между собой атомов кислорода 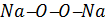 .
.
Основания - это гидроксиды металлов, при диссоциации которых образуются гидроксид-ионы ( ) и основные остатки:
) и основные остатки:
 .
.
Кислотность оснований определяется числом гидроксид-ионов в молекуле основания. Многокислотные основания диссоциируют ступенчато:
 .
.
Названия оснований составляют из слова «гидроксид» и названия металла (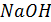 – гидроксид натрия) с указанием валентности, если металл образует несколько оснований, например:
– гидроксид натрия) с указанием валентности, если металл образует несколько оснований, например:  - гидроксид железа (II),
- гидроксид железа (II),  - гидроксид железа (III).
- гидроксид железа (III).
По растворимости в воде различают: основания, растворимые в воде – щелочи (гидроксиды щелочных и щелочно-земельных металлов), основания, нерастворимые в воде, например  ,
,  ,
, 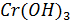 и др.
и др.
Водные растворы щелочей изменяют окраску индикаторов: в их присутствии лакмус синеет, бесцветный фенолфталеин становится малиновым, метиловый оранжевый – желтым. Щелочи получают, растворяя в воде оксиды щелочных и щелочно-земельных металлов.
Основания реагируют с кислотными оксидами и кислотами с образованием соли и воды и не реагируют с основными оксидами и щелочами 
|
|
|
 ;
;
 .
.
Нерастворимые основания разлагаются при нагревании.
Амфотерные гидроксиды проявляют как основные, так и кислотные свойства. К ним относятся, например,  ,
,  ,
,  ,
,  и др.
и др.
|
|
|


