 |
Эндотелиальная кератопластика (обзор литературы)
|
|
|
|

| 1МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова Росмедтехнологии» Минздрава РФ |

Рис. 1. Глаз пациента после DLEK
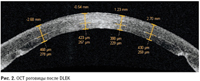
Рис. 2. ОСТ роговицы после DLEK
Эндотелиальная дистрофия роговицы различной этиологии является одним из ведущих показаний к кератопластике в мире. По данным Ассоциации глазных банков США (EBAA) частота выполнения эндотелиальной кератопластики у пациентов с патологией эндотелия роговицы с 2005 г. возросла в несколько раз и к 2009 г. достигла 45% от всех выполненных в стране кератопластик. Из них в 7-31% случаях — по поводу вторичной ЭЭД (псевдофакичная и афакичная кератопатия), в 10-25% — по поводу первичной дистрофии Фукса в сочетании с операций факоэмульсификации катаракты с имплантацией интраокулярной линзы [13, 14, 20, 25, 26, 40, 53].
В Российской Федерации на 2004 г. насчитывается более 500 тысяч слабовидящих и слепых, из них до 18% приходится на пациентов с патологией роговицы [9, 10]. За последние 5 лет в головной организации МНТК «Микрохирургия глаза» ежегодно до 30% операций кератопластики проводится по поводу ЭЭД различной этиологии. Для лечения пациентов с ЭЭД долгие годы единственным общепризнанным методом хирургической реабилитации являлась сквозная кератопластика (СКП) [42].
При всей относительной сложности данной операции она не требовала наличия дорогих высокотехнологичных инструментов, а с учетом возможных особенностей приживления трансплантата, течения послеоперационного периода, наличия характерных рефракционных нарушений результат лечения часто устраивал как пациента, так и хирурга. Особенно следует отметить тот факт, что вторичная ЭЭД (буллезная кератопатия), возникшая после удаления катаракты, относится к категории помутнений роговицы, неблагоприятных для проведения кератопластики, с высоким риском развития болезни трансплантата [4]. Для улучшения биологических результатов СКП в разное время было предложено большое количество ее модификаций (конусная, грибовидная, ступенчатая, криокератопластика и др.) [7, 9].
|
|
|
Под термином «эндотелиальная кератопластика» в настоящее время принято понимать совокупность хирургических методик, применяемых для лечения пациентов с патологией эндотелия роговицы и характеризующихся селективной заменой его трансплантатом задних слоев донорской роговицы.
При обзоре отечественных литературных источников обратило на себя внимание, что первое сообщение о задней послойной кератопластике (ЗПК) как патогенетически ориентированного метода лечения ЭЭД роговицы опубликовано профессором Волковым В.В. в 1976 г. [1]. В работе Гундоровой Р.А. и Бойко А.И., опубликованной в 1974 г., ЗПК применялась в иной модификации для замещения задних слоев роговицы при посттравматическом врастании эпителия. Авторами отмечен положительный результат проведенного лечения в пяти из шести случаев [2].

Рис. 3. Состояние глаза до и через 3 мес. ЗАПК+ФЭК+ИОЛ. Vis=0,6 без коррекции
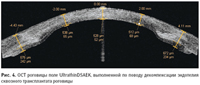
Рис. 4. ОСТ роговицы поле UltrathinDSAEK, выполненной по поводу декомпенсации эндотелия сквозного трансплантата роговицы
При детальном ознакомлении с иностранной литературой обнаружено, что уже в середине прошлого столетия Tillet C. и Barraquer J. предприняли первые попытки выполнения операции по замене внутренних (глубоких) слоев роговицы реципиента с измененным эндотелием на здоровые, взятые у донора. Методики обоих авторов являлись сходными и предполагали так называемый «наружный» подход» к задним слоям роговицы через поверхностный лоскут стромы, выкроенный мануально на уровне 2/3 стромы роговицы с последующей трепанацией и иссечением задних слоев роговицы реципиента и заменой их аналогичным трансплантатом задних слоев, выкроенным из здоровой донорской роговицы. При этом поверхностный и глубокий лоскуты фиксировались узловыми швами [16, 52]. Стоит подчеркнуть, что именно в этих работах была показана принципиальная возможность восстановления прозрачности всей роговицы реципиента (при отсутствии грубых стромальных помутнений) за счет восстановления нормально функционирующих задних слоев.
|
|
|
Разработке метода ЗПК в различных его модификациях в нашей стране принадлежат также работы Дронова М.М., Мороз З.И., Тоцкой Т.Д., Горгиладзе Т.У. Максимальное значение остроты зрения в большинстве случаев составило 0,2-0,3, при этом в 80% случаев наблюдали прозрачное приживление трансплантата [3, 8, 11, 12, 54].
Подобные операции не получили широкого распространения по причине целого ряда проблем. Операция, так же как и сквозная кератопластика, протекала по типу «открытого неба» с продолжительной разгерметизацией глазного яблока и имела высокий риск развития интраоперационных осложнений. Техническая сложность мануальной диссекции трансплантата задних слоев донорской роговицы сопровождалась травмой эндотелиальных клеток донорской роговицы. Необходимость шовной фиксации, как трансплантата, так и поверхностного лоскута роговицы, не исключала возможности нарушения адаптации трансплантата к строме собственной роговицы в результате неконгруэнтности поверхностей, а также неравномерности натяжения швов и развития внутренней и наружной фильтрации влаги передней камеры. При этом успешно выполненная операция не гарантировала получения высокого функционального результата по причине развития неправильного астигматизма, нарушения топографии роговицы и помутнением в зоне стромального контакта (интерфейса).
Кардинально новый, «внутренний» подход» к замене повреждённого эндотелия реципиента трансплантатом задних слоев роговицы через лимбальный разрез впервые был предложен в 1993 г. Ko W. и Feldman S. в экспериментальных работах [23]. Идея авторов была подхвачена другими исследователями и привела к появлению метода задней послойной кератопластики в модификациях PLK (posterior lamellar keratoplasty) и более популярной DLEK (deep lamellar endothelial keratoplasty), предложенной MarkTerry в 2001 г. [30, 32, 33, 44-46, 49, 51]. Операция включала удаление диска задних слоев роговицы при помощи оригинальной модели трепана, введенного в расслоенную роговицу реципиента на уровне 2/3 стромы через лимбальный разрез 9 мм. Трансплантат задних слоев диаметром 8 мм вводился в переднюю камеру в сложенном состоянии, расправлялся при помощи физиологического раствора и прижимался к задней поверхности роговицы реципиента при помощи заполнения передней камеры воздухом без дополнительных фиксирующих швов. Основной разрез герметизировали наложением узловых швов. В послеоперационном периоде отмечали ускоренное восстановление остроты зрения, средние значения которой к 6 мес. после операции достигали 0,5 (от 0,1 до 0,8) (рис. 1, 2). Позднее была показана возможность проведения такой операции через лимбальный разрез 5,0 мм, расположенный с височной стороны. При сравнении результатов в группах пациентов с разрезом 9 и 5 мм астигматизм составил 1,63±0,97 и 1,39±0,65 дптр, а потеря ПЭК — 22 и 28% соответственно [44, 48, 50].
|
|
|
C этого времени эндотелиальную кератопластику стали проводить по типу операции «закрытого неба», что в значительной мере повысило безопасность операции пересадки роговицы и послужило стимулом к популяризации и дальнейшему развитию послойных методик кератопластики. Впервые была доказана возможность фиксации и адгезии трансплантата на задней поверхности роговицы при помощи воздушной тампонады передней камеры, создаваемой в завершении операции по аналогии с пневморетинопексией при отслойке сетчатки, что полностью исключило необходимость наложения швов. Однако уменьшение операционного доступа привело к увеличению потери эндотелиальных клеток и явилось стимулом к разработке новых способов и устройств имплантации донорской ткани.
В 2004 г. Melles G. с соавт. предложена техника десцеметорексиса — удаления патологически измененного эндотелия с десцеметовой мембраной через микроразрез с полным сохранением собственной стромы роговицы реципиента [34]. Это значительно упростило этап подготовки роговицы реципиента и обеспечило высокое качество стромальной поверхности донора.
|
|
|
Результаты сканирующей электронной микроскопии, полученные Terry M. et al., подтвердили формирование более гладкой, равномерной поверхности при механическом отслаивании десцеметовой мембраны роговицы реципиента в сравнении с мануальным расслаиванием и иссечением задних слоев роговицы [47].
В 2005 г. Price F. опубликовал результаты первых 50 операций с использованием десцеметорексиса и ввел термин DSEK, являющийся аббревиатурой понятия Descemet’s stripping endothelial keratoplasty, что на русский язык можно перевести как «эндотелиальная кератопластика с отслаиванием десцеметовой мембраны» [38].
Создание гладкой задней поверхности роговицы реципиента при помощи десцеметорексиса и бесшовная техника фиксации трансплантата воздухом привели к увеличению частоты одного из самых грозных осложнений эндотелиальной кератопластики — отслойке и дислокации трансплантата. Частота этого осложнения на начальных этапах составляла по данным различных авторов до 50%. Дополнительные манипуляции, включающие репозицию и повторную воздушную тампонаду передней камеры глаза реципиента, оказывали травму клеткам эндотелия донора, снижая жизнеспособность пересаженной ткани. В некоторых случаях это могло приводить к полной декомпенсации трансплантата и необходимости его замены уже в раннем послеоперационном периоде. Единого решения данной проблемы не существует до сегодняшнего времени, однако достоверно установлена взаимосвязь между временем воздушной тампонады и частотой дислокации. Положительное влияние также оказывают роговичные парацентезы, выполненные на всю толщину роговицы реципиента перед этапом имплантации донорской ткани для обеспечения возможности дополнительного дренирования влаги из области интерфейса после заполнения передней камеры и прижатия трансплантата воздухом [27].
Технически сложный, травматичный, малопредсказуемый и длительный процесс мануальной диссекции трансплантата задних слоев из донорской роговицы был значительно упрощен и во многом лишен всех своих недостатков после предложения в 2006 г. Gorovoy M. использовать для этого автоматизированный микрокератом [15, 21]. Применение микрокератома позволило обеспечить создание гладкого, равномерного и контролируемого по глубине среза с высоким качеством стромальной поверхности роговицы донора. Автор дополнил название методики — DSAEK (Descemet’s stripping automated endothelial keratoplasty). Именно эту методику чаще всего подразумевают под задней автоматизированной послойной кератопластикой (ЗАПК) в настоящее время.
|
|
|
В 2003 г. Seitz B. с соавт. впервые использовал технологию фемтосекундной лазерной диссекции стромы роговицы in vitro для выкраивания эндотелиального диска [39].
В 2007 г. Cheng Y. с соавт. впервые успешно выполнена ЗАПК с применением фемтосекундного лазера (FS-DSAEK) у пациентки с буллезной кератопатией на фоне артифакии [18].
В настоящее время операция ЗАПК/DSAEK является наиболее часто применяемой методикой хирургического лечения пациентов с патологией эндотелия роговицы различного генеза в развитых странах [43]. Причинами популярности данного метода можно назвать следующие:
1. ЗАПК позволяет добиться быстрой зрительной реабилитации пациентов (рис. 3). Различные источники сообщают о средней максимально корригированной остроте зрения?0,5 у 28-100% пациентов к 6 мес. и 66-100% к 1 году после операции. Острота зрения?0,8 также наблюдается в 6-20% случаев к году после операции.
2. Отсутствие обширного рубца роговицы позволяет сохранить биомеханическую прочность наружной оболочки глаза и ее устойчивость к травме.
3. Полное сохранение стромы роговицы реципиента не приводит к нарушению трофики и иннервации роговицы.
4. Минимальное изменение состояния глазной поверхности и топографии роговицы.
5. Операция не требует дополнительных манипуляций в отдаленном послеоперационном периоде.
6. Методика ЗАПК обладает высокой воспроизводимостью, а также может комбинироваться с другими манипуляциями, такими как факоэмульсификация катаракты с имплантацией ИОЛ, удаление и замена ИОЛ, подшивание ИОЛ, пластика радужной оболочки, формирование зрачка, витрэктомия, реконструкция переднего отрезка глаза с рассечением синехий и удалением мембран.
Оценка отдаленных результатов ЗАПК/DSAEK позволила выявить некоторые особенности данной методики. Во-первых, это возникновение гиперметропического сдвига рефракции в послеоперационном периоде в среднем на 1,5 дптр. Во-вторых, обнаружено, что даже при отсутствии сопутствующей патологии глаза лишь 19% пациентов имеют остроту зрения, равную 1,0. Часть авторов находили взаимосвязь описанных особенностей с формой и толщиной эндотелиального трансплантата [19, 37]. В связи с чем возникла новая идея формирования ультратонкого трансплантата задних слоев роговицы. Это достигалось выполнением микрокератомом нескольких срезов для формирования эндотелиального трансплантата с наименьшей толщиной остаточной стромы (Ultrathin DSAEK) (рис. 4). Ранние клинические исследования показали возможность проведения такой манипуляции, а также обеспечение более высоких показателей остроты зрения в группе пациентов, оперированных по данной методике по сравнению со стандартной ЗАПК [5, 6].
Тем не менее до настоящего момента не существует единого мнения на предмет рациональности и необходимости широкого применения методики ЗАПК с формированием ультратонкого трансплантата, так как она сопряжена с риском выбраковки донорского материала по причине перфорации на этапе выкраивания. Отсутствует и четкая граница толщины эндотелиального трансплантата, по достижении которой его можно расценивать как ультратонкий. В единичных работах фигурирует верхнее значение центральной толщины ультратонкого эндотелиального трансплантата, равное 131 мкм [37].
В 2006 г. после нескольких лет лабораторных исследований Mellesс G. соавт. представил метод трансплантации десцеметовой мембраны, обозначив ее название как DMEK (Descemet’s membrane endothelial keratoplasty) [31, 35]. Трансплантация десцеметовой мембраны является наиболее совершенным методом по отношению к восстановлению истинной анатомии роговой оболочки, способным обеспечить максимально высокие клинико-функциональные результаты лечения, которые подтверждаются отдельными сообщениями о достижении пациентами остроты зрения 2,0. Согласно данным острота зрения?0,7 отмечается у 43% пациентов через 1 мес. и у 71% — к 6 мес. после операции. Однако отслойка трансплантата наблюдается в среднем в 30% случаев, которая, как правило, купируется повторным введением воздуха в переднюю камеру [36].
Несмотря на преимущества, операция до сегодняшнего времени выполняется в единичных центрах по всему миру, так как является технически наиболее сложной в связи с деликатностью и особенностями манипуляций с изолированной десцеметовой мембраной. Также есть ряд противопоказаний, ограничивающих ее применение: операция, как правило, выполняется в начальных стадиях заболевания, так как визуализация и манипуляция донорской тканью при наличии выраженного стромального отека значительно затруднены, а нестабильность передней камеры, наличие спаек и синехий могут привести к дополнительной травме эндотелия. Частота выбраковки донорского материала по причине разрыва десцеметовой мембраны на этапе отсепаровки ее от донорской роговицы по различным данным составляет от 0,5 до 82% случаев, что существенно ограничивает ее в условиях дефицита донорской ткани.
В России изучению и разработке данного метода посвящены работы Оганесяна О.О. с соавт. Автором предложен термин «микроинвазивная десцеметопластика», разработана оригинальная модель устройства для имплантации донорской ткани через микроразрез (1,8 мм), а также представлена модель реэндотелиазации роговицы в послеоперационном периоде [10].
Studeny P. с соавт. предложили использование аэросепарации десцеметовой мембраны после механического расслаивания поверхностных слоев стромы подобно технике передней глубокой послойной кератопластики (DALK) [41]. Другими авторами было предложено использование на данном этапе микрокератома, а методика получила название DMAEK (Descemet’s membrane automated endothelial keratoplasty) [28]. Трансплантат, выкроенный таким образом, представляет собой десцеметовую мембрану с периферическим кольцевидным ободком стромы, служащим в качестве ее поддержки, и может имплантироваться любым устройством, используемым при ЗАПК. Результаты остроты зрения данной методики сравнимы с таковыми после трансплантации десцеметовой мембраны.
Основной проблемой эндотелиальной кератопластики в любых ее модификациях до настоящего времени является потеря эндотелиальных клеток, связанная с механической травмой эндотелиального пласта на различных этапах работы с деликатным донорским материалом и приводящая к развитию первичной декомпенсации (несостоятельности) трансплантата (primary graft failure).
На ранних этапах ЗПК для введения трансплантата в переднюю камеру глаза реципиента использовали пинцет. Трансплантат захватывали в сложенном виде (50:50 или 40:60). В части случаев это приводило в инвертному прижатию трансплантата после расправления его. Потеря ПЭК к 6 мес. после операции по данным различных авторов составила от 34 до 63%. Изучение in vitro выявило потерю ПЭК, равную 38% (22,2-52,4%) в зоне контакта эндотелия при смыкании браншей пинцета [29]. Позже были предложены различные модификации атравматичных браншей пинцета, однако это не уменьшило сложность и травматичность расправления трансплантата в передней камере.
В 2007 г. Mehta J. с соавт. предложил методику введения эндотелиального трансплантата при помощи глайда и пинцета для капсулорексиса. Экспериментальное исследование in vitro выявило повреждение ПЭК, равное 9% (3,9-16,8%). Клиническая потеря ПЭК составила 26% [29].
В 2008 г. Busin M. с соавт. предложил методику имплантации с использованием оригинальной модели глайда (Businglide) [17]. Устройство выполнено из металла и имеет форму воронки, в которую укладывается трансплантат эндотелием наружу. Устройство переворачивается и вводится в корнеосклеральный разрез 4,5 мм. Трансплантат вводится в переднюю камеру при помощи микропинцета, введенного через парацентез и активную ирригацию.
В 2009 г. группа авторов во главе с Tan D. представила новою модификацию глайда для имплантации ЕndoGlide. Экспериментальное исследование in vitro выявило повреждение ПЭК, равное 5,3%. Клиническое исследование глайда указывают на потерю ПЭК, равную 15,6% (7,0-24,2%) к 1 году после операции [22]. Имеются упоминания о разработке новой модификации данного глайда, адаптированного для имплантации ультратонкого трансплантата при ЗАПК.
Одновременно в 2009 г. Walter K. с коллегами представил оригинальную модель инжектора EndoSaver [55]. Донорский диск помещается на гибкую подложку, после чего втягивается внутрь устройства. Имплантация осуществляется через разрез 4,0 мм при активной ирригации, подсоединенной к инжектору, для поддержания стабильной глубины передней камеры и не требует дополнительных инструментов.
В работах Melles G. при трансплантации десцеметовой мембраны используется модель сборного инжектора, состоящего из шприца, трубки и одноразового инжектора для имплантации мягкой интраокулярной линзы. Окрашенная при помощи 0,06%-ного раствора трепанового синего десцеметовая мембрана вводится в переднюю камеру через разрез 3,5 мм. По последним литературным данным, потеря ПЭК составляет в среднем 28% к 6 мес. после операции и сравнима с таковой при ЗАПК. Отмеченная потеря ПЭК на этапе отделения десцеметовой мембраны от донорской роговицы составляет 3,4% [24].
Таким образом, современные исследования в области эндотелиальной кератопластики активно продолжаются и направлены на поиск оптимальных технических приемов по имплантации донорской ткани для снижения ее травматизации. Для преодоления этих трудностей были предложены различные модификации хирургических техник: PLK, DLEK, DSEK, DSAEK FS-DSAEK, DMAEK, DMEK-S, DMEK, а также различные варианты инжекторов и глайдов.
Суммируя выше сказанное, следует подчеркнуть, что внедрение современных методов эндотелиальной кератопластики в клиническую практику является большим достижением и по своей значимости сравнимо с внедрением метода факоэмульсификации. Особенно привлекают микроинвазивность и малая травматичность подхода, направленного на селективную замену исключительно тех слоев роговой оболочки, которые вовлечены в патологический процесс. Дальнейшая разработка и совершенствование данных методов, более широкое внедрение в клиническую практику являются одним из наиболее актуальных и перспективных направлений офтальмотрансплантологии.
|
|
|


