 |
рН-зависимые электродные потенциалы
|
|
|
|
ЭЛЕКТРОДЫ 1-ГО ПОРЯДКА
Металлический электрод
Металлический электрод является электродом первого рода и представляет собой металл, погруженный в раствор его соли. Уравнение Нернста для металлического электрода приобретает следующий вид (при 298,15 К)

где ам и а m n + — активности металла и его ионов, соответственно.
Принято, что активность любого чистого кристаллического вещества равна единице (ам = 1), и, таким образом, она устраняется из формулы. Это вполне согласуется с тем, что скорость любой химической реакции не зависит от концентрации твердого вещества в объеме фазы, а может зависеть лишь от площади поверхности. В данном случае, чем больше поверхность металла, тем больше скорость ухода ионов в раствор и скорость их обратного перехода в кристаллическую решетку металла. Таким образом,

В очень разбавленном растворе, где активности мало отличаются от концентраций (амп+ = Смn+) вместо активной концентрации можно подставить молярную концентрацию:
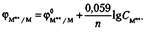
В этой формуле ф°мn+ /м — стандартный потенциал металлического электрода при активности катионов, равной 1 моль/л, который зависит от температуры и природы металла.
По мере роста величины потенциала металлического электрода падает восстановительная активность металла. Эта зависимость известна как ряд напряжений металлов, впервые сформулированный Н. Н. Бекетовым.
Потенциал металлического электрода зависит только от концентрации катионов металла и не зависит от концентрации анионов. Следовательно, металлический электрод относится к электродам первого рода.
Водородный электрод
К числу электродов первого рода принадлежит и водородный электрод, стандартный потенциал которого условно принят за ноль.
|
|
|
Водородный электрод представляет собой пластинку из инертного металла (платины), погруженную в раствор, содержащий ионы водорода, например, в раствор Н25О4(рис. 12.1). Предварительно электролизом раствора хлорида платины на пластинку наносится слой платиновой черни. Такая платинированная пластинка обладает большой активной поверхностью и способна поглощать большое количество водорода. Через раствор пропускают ток чистого газообразного водорода при постоянном давлении (100 кПа).
Газообразный водород адсорбируется на платине и затем, распадаясь на атомы, переходит в раствор в виде ионов. Таким образом, между атомами водорода на платине и ионами водорода в растворе в водородном электроде устанавливается равновесие:

Схематически водородный электрод записывается так:

Очевидно, что он аналогичен металлическому электроду.
Применяя уравнение Нернста при 298,15 К для водородного электрода, получим:
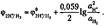
Активность газа ан2 равна его давлению ан2 = рн2, тогда при давлении ри2 = 100 кПа




Таким образом, потенциал водородного электрода зависит от активности ионов водорода и, следовательно, его можно применять для измерения рН. При отсутствии посторонних окислителей и восстановителей водородный электрод является самым точным электродом для измерения кислотности среды в широком интервале рН — от сильнокислой до сильнощелочной среды.
Посторонними окислителями могут быть многие органические вещества, способные восстанавливаться водородом в присутствии платины. Платина легко отравляется галогенами, соединениями серы, ртути и мышьяка, которые уменьшают ее способность поглощать водород. Установка для измерения рН с водородным электродом включает электролизер для получения водорода и систему поглотительных склянок для тщательной очистки водорода от других газов и потому является громоздкой. Кроме того, перед измерением рН требуется длительное насыщение раствора водородом.
|
|
|
Поэтому вместо водородного в качестве электродов сравнения, как правило, использл' ют каломельный и хлорсеребряный электроды.
ЭЛЕКТОРОДЫ 2-ГО ПОРЯДКА
Каломельный электрод
К электродам второго рода, как уже отмечено, принадлежат электроды, обратимые относительно катиона и аниона. В электродах второго рода металл погружен в раствор своей труднорастворимой соли и хорошо растворимого электролита с одноименным анионом.
Так, каломельный электрод состоит из металлической ртути, которая находится на дне сосуда, а сверху покрыта пастой из каломели Hg2Cl2. Сосуд наполняется раствором КС1 определенной концентрации, насыщенным Hg2Cl2.
Схема записи каломельного электрода: Hg | Hg2Cl2, KC1. На каломельном электроде устанавливаются равновесия:

Рассматривая этот электрод как обратимый относительно катиона, применим к нему уравнение Нернста для металлического ртутного электрода (при 298,15 К):

Активная концентрация ионов Hg22+ в растворе, возникающая за счет незначительной растворимости каломели, связана с активной концентрацией ионов С1-:


Подстановка величины aHg 2 2+ в формулу приводит к выражению:

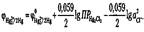
Как видно из формул, потенциал каломельного электрода действительно зависит и от концентрации катиона Hg22+, и от концентрации аниона Cl-. Вообще, если металлический электрод находится в насыщенном растворе своей соли, то его потенциал определяется концентрацией катионов в растворе, но изменение концентрации анионов влияет на концентрацию катионов и в результате вызывает изменение потенциала электрода. Сумма постоянных величин

является постоянной.
Обозначая ее ф0клм, получим:

Суммарная концентрация ионов хлора в растворе практически равна концентрации раствора КС1 в каломельном электроде.
Избыток КС1 гарантирует, что раствор остается насыщенным при значительных изменениях температуры. Наиболее удобен и устойчив, а потому чаще применяется на практике насыщенный каломельный электрод, содержащий насыщенный раствор хлорида калия.
Хлорсеребряный электрод
Другим электродом второго рода является хлорсеребряный электрод, простой в изготовлении и дающий хорошо воспроизводимую величину потенциала.
|
|
|
Он применяется как внутренний вспомогательный электрод в стеклянных электродах, а также в качестве внешнего стандартного электрода сравнения при измерении рН.
Хлорсеребряный электрод обычно получают осаждением серебра на платиновую проволоку с последующим переведением поверхностного слоя осажденного серебра в хлорид серебра электролизом в растворе хлорида. Эта проволока погружена в раствор хорошо растворимого электролита, содержащего ионы С1- (например, раствор КС1, насыщенный AgCl).
Схема хлорсеребряного электрода: Ag | AgCl, KC1.
На рис. 12.3 приведена одна из конструкций хлорсеребряного электрода. Этот электрод состоит из стеклянного корпуса 1 с впаянной асбестовой нитью 2, по которой просачивается раствор хлорида калия (насыщ.), создавая электролитический ключ. Внутри электрода находятся серебряная проволока 5 и паста из хлорида серебра 4. Корпус полностью заполняется насыщенным раствором хлорида калия 3, контакт которого с парой Ag | AgCl осуществляется при помощи асбестового фитиля 6. На электроде происходит реакция:

Потенциал хлорсеребряного электрода, выведенный из уравнения Нернста так же, как и для каломельного, имеет вид:

На практике, как и в случае каломельного, чаще используется насыщенный хлорсеребряный электрод, потенциал которого при данной температуре постоянен, и при 298 К равен 0,202 В.
Сурьмяный электрод
Сурьмяный электрод является одним из наиболее употребимых металлоксидных электродов, которые обычно относятся к электродам второго рода, только в отличие от каломель ного и хлорсеребряного электродов, здесь металл (Sb) погружен в концентрированный раствор труднорастворимого оксида Sb2O3.
Для бруска сурьмы, отлитого на воздухе, электрохимический процесс протекает с участием сурьмы и тонкого слоя ее малорастворимого оксида на поверхности металла:

Сурьма и ее оксид находятся в кристаллическом состоянии, и, следовательно, их активности не изменяются. Активная концентрация воды в разбавленных растворах также приблизительно постоянна. Поэтому потенциал электрода зависит только от активной концентрации ионов водорода, и, следовательно, сурьмяный электрод можно использовать для измерения рН:
|
|
|

Потенциал сурьмяного электрода зависит от состояния поверхности металла. Кроме того, на его величину влияют окислители и восстановители. Поэтому с его помощью измеряют рН в тех случаях, когда не требуется высокая точность. Однако сурьмяный электрод имеет очень простое устройство, легко может быть выполнен в виде электрода очень малых размеров, и потенциал его устанавливается очень быстро.
Сурьмяный электрод нашел, в частности, применение при изучении изменений рН в желудке в процессе пищеварения. Он представляет собой брусок сурьмы длиной 5 мм и диаметром 1 мм с трехжильным медным проводом, который можно легко проглотить. Вспомогательный сурьмяный электрод можно включать в цепь, например, с помощью солевого раствора, в который помещены ноги пациента.
Хингидронный электрод
Хингидронный электрод является представителем окислительно-восстановительных электродов.
Как известно, многие окислительно-восстановительные реакции в водных растворах протекают с участием ионов водорода. В этом случае потенциал редокс-электрода зависит от концентрации ионов Н*. Такие электроды в принципе можно использовать для измерения рН. Из них наибольшее практическое применение нашел Хингидронный электрод.
Для приготовления этого электрода исследуемый раствор взбалтывают со щепоткой хин-гидрона (труднорастворимого темно-зеленого порошка) и таким образом получают его насыщенный раствор. Хингидрон является молекулярным соединением хинона и гидрохинона и при растворении в воде частично диссоциирует на хинон и гидрохинон:
В полученный раствор погружают платиновую пластинку. Хинон и гидрохинон участвуют в окислительно-восстановительном равновесии, от положения которого зависит потенциал платиновой пластинки:
Схема хингидронного электрода: Pt | X, ГХ, Н+.
Применение формулы Нернста для этой окислительно-восстановительной реакции позволяет получить потенциал хингидронного электрода:

Активные концентрации хинона (a х) и гидрохинона (агх) в растворе примерно равны, так как они образуются эквимолярно в результате диссоциации хингидрона. Поэтому
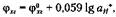
где ф0 гх — величина стандартного потенциала хингидронного электрода при а+н = 1, равная 0,699 В. Отсюда

Хингидронный электрод удобен в работе и позволяет определять рН кислых и слабощелочных растворов с достаточной точностью. В щелочных растворах (при рН > 8) он не дает точных показаний из-за диссоциации гидрохинона, в результате чего концентрация гидрохинона меняется:
|
|
|

Присутствие в растворах окислителей и восстановителей влияет на потенциал хингидронного электрода. Кроме того, при измерении рН в исследуемый раствор приходится вносить постороннее вещество — хингидрон.
Поэтому хингидронный электрод в отличие от более совершенного и универсального стеклянного электрода нельзя применять для измерения рН многих биологических жидкостей.
Вообще хинонные и гидрохинон-
ные структуры широко распространены в живой клетке: их имеют, например, такие важные для жизнедеятельности вещества, как витамины Е и К.
рН-зависимые электродные потенциалы
Полуреакция, происходящая на хингидронном электроде, протекает с участием ионов гидроксония. Существует большая группа полуреакций, в которых участвуют протоны или гидроксильные ионы. В таких случаях концентрация этих ионов входит в уравнение Нернста и рН раствора влияет на потенциал полуреакции.
Например, потенциал редокс-пары

будет вычисляться по уравнению:

Для водных растворов активную концентрацию воды можно считать величиной постоянной и потому ее значение учитывается в постоянной величине стандартного потенциала.
В общем виде зависимость окислительно-восстановительного потенциала от рН для уравнения

можно записать так:

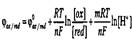
Из этого уравнения следует, что по мере подкисления раствора окислительно-восстановительный потенциал будет увеличиваться.
Величина сдвига ФОХ/RED при изменении концентрации ионов водорода зависит от числа электронов п и протонов т, участвующих в реакции, т.е. от отношения т/п. Такую разновидность окислительно-восстановительных полуреакций называют рH-зависимыми.
рH-зависимые полуреакции (и не только они) нашли широкое применение в клинической диагностике, являясь основой аналитических редокс-методов, прежде всего редоксимет-рии — метода объемного анализа, основанного на применении окислительно-восстановительных реакций. В зависимости от примененяемого титранта различают перманганатометрию, бихроматометрию, иодометрию, периметрию и др.
Перманганатометрия — метод, базирующийся на применении в качестве титранта-окислителя перманганата калия в сильно кислой среде. В связи с высоким значением стандартного потенциала перманганата калия (ф°MnO4- + 8h/Mn2+ = +1,51 В) его можно применять для определения широкого набора веществ, способных окисляться — сульфит-, сульфид-, нитрит-, арсенит-анионов, катиона Fe2+, гидразина, ряда органических кислот (лимонной, винной, яблочной, щавелевой, аскорбиновой и др.).
В гигиенической практике его используют для нахождения важной характеристики воды — ее окисляемости, которая определяется количеством миллиграммов пермангана-та калия, идущих на окисление восстановителей, содержащихся в литре воды. Окисляемость обусловлена присутствием гуминовых веществ, сероводорода, солей двухвалентного железа и др. примесей, в основном бытовых или промышленных. Загрязненные воды имеют окис-ляемость до 400 мг на литр воды, а незагрязненные — не более 4 мг на литр. Наименее загрязнены артезианские воды (окисляемость менее 2 мг на литр).
Бихроматометрия также основана на достаточно высокой величине редокс-потенци-ала бихромат-иона в сильно кислой среде. Значение ф° для полуреакции

составляет +1,33 В. Бихроматометрию используют для определения многих восстановителей, а в гигиенической практике она нашла применение для определения химического потребления кислорода — оценки содержания всех органических веществ, которые растворены в воде. Они при кипячении в избытке бихромата калия в присутствии серной кислоты окисляются до углекислоты.
|
|
|


