 |
Экспериментальная часть.
|
|
|
|
СОДЕРЖАНИЕ
1. Введение
2. Свойства вещества
2.1 Свойства вещества
2.2 Методики синтеза
2.3 Термодинамические расчеты
3. Экспериментальная часть
3.1 Методика выбранного синтеза
3.2 Предварительные расчеты
3.3 Ход работы
3.4. Результаты синтеза
3.5 Идентификация вещества
4. Вывод
5. Список литературы
ВВЕДЕНИЕ
Никель(II) углекислый основной - промежуточный продукт при аммиачном выщелачивании никелевых руд. Предварительно руды, подвергают восстановительному обжигу. Выщелачивание производят водным раствором аммиака, содержащим карбонат аммония, в присутствии кислорода. Химическая формула: NiCO3 x mNi(OH)2 x nH2O
Никель(II) углекислый основной представляет собой смесь непостоянных количеств углекислого никеля и гидрата закиси никеля. Его состав зависит от условий получения и главным образом от значения рН среды, из которой его получают. В воде он изменяет свой состав вследствие взаимодействия с водой и постепенно переходит в более основную соль. Это кристаллический порошок, нерастворимый в воде и растворимый в кислотах и концентрированном растворе - карбоната аммония. Кристаллы основного карбоната никеля окрашены в зеленый цвет, который может иметь различные оттенки в зависимости от химического состава и величины его частиц.
Его применяют в производстве никельсодержащих катализаторов, в качестве пигмента для стекла и керамики, для получения солей никеля, в электротехнике. Хранят в стеклянных банках с пришлифованной пробкой; в стеклянных банках с навинчивающейся крышкой из полимерного материала (или алюминия), имеющей полиэтиленовый вкладыш; в пакетах из неокрашенной полиэтиленовой пленки; в мешках из неокрашенной полиэтиленовой пленки.
|
|
|
Теоретическая часть
2.1 СВОЙСТВА ВЕЩЕСТВА
Кристаллический зеленый порошок. Хорошо растворим в разбавленных кислотах, почти нерастворим в воде (ПР ≈ 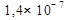 при 25º)
при 25º)
Основной карбонат никеля при нагревании разлагается с выделением воды и углекислого газа и переходит в отсутствие кислорода в закись никеля, а в присутствии кислорода в смесь окислов, так как адсорбирует кислород. При высокой температуре (выше 700º С) получается только закись никеля, так как адсорбции кислорода при этом не происходит.
Доделать
2.2 МЕТОДИКИ СИНТЕЗА
Общим методом получения никеля(II) углекислого основного является взаимодействие растворимых солей никеля с карбонатами других металлов.
1.. В кипящий раствор 100 г Na2CO3 (ч.д.а) в 400 мл воды приливают нагретый до кипения раствор 100 г NiCl2; реакция раствора должна оставаться щелочной. Выпавший осадок отсасывают на воронке Бюхнера, промывают горячей водой и сушат при 25-30º С
выход: 90 г
2. 100 г продажного кизельгура, не содержащего окислов железа, растирают в фарфоровой чашке или ступке в течение 30— 40 мин с раствором азотнокислого никеля (116 г соли в 160 мл воды) до получения однообразной текучей массы. Последнюю медленно при перемешивании приливают к раствору углекислого аммония (70 г в 400 мл воды). Осадок основного углекислого никеля на кизельгуре фильтруют на воронке Бюхнера, дважды промывают водой порциями по 200 мл, отжимают и сушат в сушильном шкафу при температуре l0ºC в течение 5—6 ч. Полученный в виде светлозеленых кусочков катализатор хранят в закрытой стеклянной банке.
выход: 40 г
2.3 ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ
Рассчитаем энергию образования вещества, используя для этого энергию Гиббса:
2 NiCl2 (тв)+ 2 Na2CO3(тв)+ Н2О(ж) = (NiOH)2CO3(тв)+ CO2(г)+ 4 NaCl(тв)
| NiCl2 (тв) | Na2CO3(тв)* | H2O(ж) | (NiOH)2CO3(тв) | CO2(г) | NaCl(тв) | |
Δ  кДж/моль
кДж/моль
| -1047,5 | -237,24 | -394,6 | -384, 0 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
|
|
|
3.1 МЕТОДИКА ВЫБРАННОГО СИНТЕЗА
Выбранная методика позволяет получить максимально чистое вещество с минимальными потерями, кроме того легка в выполнении.
Данный метод проходит по следующей реакции:
2 NiCl2 + 2 Na2CO3 + Н2О = (NiOH)2CO3+ CO2+ 4 NaCl
Для проведения синтеза понадобится:
· химический термостойкий стакан на 100 мл (2), мерный цилиндр 100мл (1), стеклянная палочка, фильтровальная бумага, воронка Бюхнера с водоотсасывающим насосом, электронные весы, электрическая плитка
· NiCl2 * 6H2O, Na2CO3 * 10H2O, вода дистиллированная
3.2 ПРЕДВАРИТЕЛЬНЫЕ РАСЧЕТЫ
3.3 ХОД РАБОТЫ
3.4 РЕЗУЛЬТАТ СИНТЕЗА
3.5 ИНДЕТИФИКАЦИЯ ВЕЩЕСТВА
ВЫВОД
В результате синтеза по выбранной методике был получен никель(II) углекислый основной
(NiOH)2CO3. Полученное вещество имеет светло-зеленую окраску, что тоже свидетельствует о получении (NiOH)2CO3.
Выход продукта составил 98%. Небольшие потери могут быть связаны с тем, что вещество состоит из мелких частиц, которые могли остаться на порах фильтровальной бумаги. Кроме того, в процессе эксперимента часть синтезируемого вещества могла остаться на стеклянной палочке или на стенках стакана.
под литературу
http://standartgost.ru/%D0%93%D0%9E%D0%A1%D0%A2%204466-78
http://www.ngpedia.ru/id076610p1.html
1, 6
http://himlib.ru/index.php?book=23&page=163 способ получения 2
|
|
|


