 |
Концепции и принципы квантового естествознания
|
|
|
|
Становление квантовых концепций. В конце XIX века состоялись открытия в разных областях физики, которые в дальнейшем послужили фундаментом при создании новой, квантовой физики. Каждое из этих открытий являлось само по себе замечательным событием в истории науки и достойно отдельного описания, поскольку этими открытиями и теориями продолжал развиваться и разрастаться уже отмеченный нами этап неклассического естествознания и неклассической науки в целом.
В 1895 году В. К. Рентген (1845-1923), занимаясь исследованием катодных лучей, обнаружил неизвестные лучи, способные проникнуть через непрозрачные (для обычного, оптического диапазона света) тела. Новые лучи Рентген назвал Х-лучами. Сейчас мы знаем, что Х-лучи (рентгеновские лучи) это не что иное, как самые обычные электромагнитные волны, но с длиной волны значительно меньшей, чем у видимого света.
В марте 1896 года (прошло всего несколько месяцев после открытия Рентгена) французский физик Анри Беккерель (1832-1908) сообщил об обнаружении им новых таинственных лучей, которые образуются в солях урана. Как станет ясно позднее, эти лучи возникают при радиоактивном распаде урана, т. е. Беккерель нашел не просто какие-то новые лучи, а обнаружил неизвестное до тех пор явление природы — радиоактивность.
В 1897 году выдающийся английский физик Джон Том-сон (1856-1940) обобщил все, что было известно к тому времени о катодных лучах, и пришел к выводу, что эти лучи — поток отрицательно заряженных частиц, которые были названы электронами. Электрон был, по существу, первой открытой элементарной частицей. Очень важная физическая характеристика — заряд электрона, была экспериментально определена только в 1912-1917 годах в работах американского физика Миллекена. Все известные к сегодняшнему дню электрические заряды других частиц оказываются всегда кратными заряду электрона.
|
|
|
Выдающиеся открытия в конце XIX — начале XX века привели к существенному изменению представлений о пространстве и времени, о материи, ее структуре и свойствах. В результате указанных фундаментальных открытий (открытие радиоактивности и электрона, построение специальной теории относительности, взаимосвязи массы и энергии, периодической таблицы химических элементов Д. И. Менделеева) рушились прежние представления об атоме, главном объекте исследований того времени, как первом и неделимом кирпичике мироздания, введенном еще Демокритом в античное время.
Исследования в области оптики, а более конкретно, изучение спектров излучения в конце XIX века, также в конечном итоге приблизили ученых к пониманию строения атома.
Важным этапом на пути к квантовой физике было возникновение понятия кванта света. В 1900 году немецкий физик Макс Планк для решения проблемы излучения абсолютно черного тела выдвинул гипотезу о том, что энергия света излучается не непрерывно (согласно электромагнитной теории), а отдельными порциями — квантами. Величина кванта энергии Е пропорциональна частоте излучения. Вот знаменитая формула Планка для энергии излучения кванта: 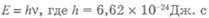 — постоянная Планка (относится к мировым, фундаментальным константам), v — частота света, Е — энергия кванта.
— постоянная Планка (относится к мировым, фундаментальным константам), v — частота света, Е — энергия кванта.
«Введение гипотезы квант равносильно крушению классической теории, а не простому ее видоизменению...», — говорил Планк.
Таинственная постоянная Планка h постепенно проникла во все разделы физики и химии. Роль открытия Планка постепенно была оценена всеми физиками. Вот какую оценку этой гипотезе дал А. Эйнштейн: «Открытие Планка стало основой всех исследований в физике
XX века и с тех пор почти полностью обусловило ее развитие... Больше того, оно разрушило остов классической механики и электродинамики и поставило пред наукой задачу: найти новую познавательную основу для всей физики».
|
|
|
Такой основой стала квантовая механика, до создания которой оставалось чуть больше двадцати лет.
Принципы квантового естествознания. Первый, но основополагающий и один из самых фундаментальных, шаг на пути зарождения квантовой механики как новой физической теории был сделан французским физиком Луи де Бройлем (1892-1987) в 1923 году, когда он в докторской диссертации выдвинул гипотезу о волновых свойствах материи. Задача, которую поставил перед собой де Бройль, состояла в том, чтобы материальной частице с массой т, движущейся со скоростью v, приписать некоторый волновой процесс, т. е. частице ставилась в соответствие волна, обладающая некоторой длиной волны де Бройля  которая определялась знаменитой формулой де Бройля:
которая определялась знаменитой формулой де Бройля:  где h — постоянная Планка.
где h — постоянная Планка.
Развивая идею де Бройля о том, что всем микрочастицам соответствуют волны, великий австрийский физик Эрвин Шредингер (1887-1961) ввел в 1926 году дифференциальное уравнение с частными производными для так называемой — функции, описывающей форму воли де Бройля. Введенная Шредингером функция задает амплитуду волн материи (волн де Бройля), изменяющихся от точки к точке и от одного момента времени к другому. Возникает естественный вопрос о физической природе волн.
Сначала физики полагали, что волны материи представляют собой реальные колебания, связанные с частицами. В частности, квадрат волновой функции электрона в атоме, на самом деле, описывает электрон не в виде частицы, а в виде электронного облака с различной плотностью в разных точках пространства. «Размазанность» электрона в пространстве не устраивала многих физиков, и тогда известный немецкий физик-теоретик Макс Борн (1882-1970) в том же 1926 году предложил вероятностную интерпретацию волновой функции. Вместо того чтобы рассматривать электрон как распределенный в некотором пространственном облаке, Борн интерпретировал квадрат — функции как плотность вероятности обнаружить электрон как частицу в той или иной точке пространства. Вероятностная интерпретация Борна хотя и является общепринятой в настоящее время, но уже давно испытывает определенные затруднения при описании явлений микромира, особенно при высоких и сверхвысоких энергиях частиц.
|
|
|
В квантовой механике при описании объекта (частицы) на первый план выступает понятие состояния объекта, отличное от классического понимания. Состояние частицы в классической физике задается координатами и скоростью частицы. В связи с невозможностью одновременного определения координаты и скорости согласно так называемому принципу неопределенности Гейзенберга, отпадает классическое задание состояния с помощью координат и импульсов. Квантовомеханичес-кое состояние задается с помощью набора квантовых чисел. Например, состояние электрона в атоме задается квантовыми числами n, l, m, и где n — главное квантовое число, l — орбитальное квантовое число, m — магнитное квантовое число, — спиновое квантовое число. Первые три квантовых числа имеют прямую связь с известными физическими характеристиками — энергией, моментом импульса и проекцией момента импульса на направление магнитного поля, соответственно. Спиновое квантовое число, или просто спин-частицы — сугубо квантовомеханическая и, даже более, квантово-релятивистская характеристика, отражающая внутренние (имманентные) свойства частицы, т. е. свойства, присущие ей по природе. Наши попытки «представить» спин частицы как величину, связанную с вращением частицы вокруг своей оси, наталкиваются на неразрешимые противоречия с теорией относительности. С другой стороны, этот факт подчеркивает то, что в микромире, макромире (и мегамире) могут существовать свои, «непересекающиеся», понятия.
Резюме
Квантовой или волновой механике (физике), созданной в течение нескольких лет в двадцатые годы XX столетия, суждено было стать фундаментом современной физики. Фундаментом, несмотря на то, что представления о частицах, из которых состоит мир, об атомах этого мира стали, с одной стороны, более глубокими и определенными, с другой стороны, стали и остаются «размытыми» и неопределенными, благодаря соотношению неопределенности Гейзенберга и корпускулярно-волновому дуализму де Бройля.
|
|
|
Необычность некоторых положений квантовой механики становится более понятной при сопоставлении, сравнении явлений и процессов, происходящих в микромире, с макроскопическими процессами. Например, длина волны де Бройля для электрона в атоме сопоставима с размерами самого атома, что дает основания говорить об электроне как о частице, так и о волне одновременно. Но, например, пылинка массой в один миллиграмм и движущаяся со скоростью один метр с секунду обладает такой мизерной длиной волны де Бройля, что о пылинке мы говорим только как о частице. Аналогичным образом, сравнивая пылинку и электрон в атоме, можно прийти к выводу (используя соотношение неопределенности Гейзенберга), что у электрона в атоме отсутствует траектория, тогда как у пылинки траектория есть.
|
|
|


