 |
Строение электронной оболочки.
|
|
|
|
Кремний.
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Кремний - элемент главной подгруппы IV группы 3-его периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14, атомной массой: 28,0855. В соединениях обычно проявляет степень окисления +4 (валентность IV) и очень редко +3, +2 и +1 (валентности соответственно III, II и I). В периодической системе Менделеева кремний расположен в группе IVA (А-обозначает, что это главная подгруппа) (в группе углерода), в третьем периоде. Неметалл. Обозначается символом Si (лат. Silicium). В свободном виде - коричневый порошок или светло-серый компактный материал с металлическим блеском. Структура решетки: кубическая, алмазная.
Основное состояние: + 14 Si14e 1s22s22p63s23p2, p-элемент.
2. Физические свойства.
Кристаллический кремний — вещество темно-серого цвета со стальным блеском. Структура кремния аналогична структуре алмаза. В его кристалле каждый атом окружен тетраэдрически четырьмя другими и связан с ними ковалентной связью, которая значительно слабее, чем между атомами углерода в алмазе. В кристалле кремния даже при обычных условиях часть ковалентных связей разрушается. Поэтому в нем имеются свободные электроны, которые обусловливают небольшую электрическую проводимость. При освещении и нагревании увеличивается число разрушаемых связей, а значит, увеличивается число свободных электронов и возрастает электрическая проводимость. Так следует объяснять полупроводниковые свойства кремния.
Кремний очень хрупок, его плотность 2,33 г/см3. Как и уголь, относится к тугоплавким веществам.
Кремний состоит из трех стабильных изотопов: 2814Si (92,27%), 2914Si (4,68%) и 3014Si (3,05%).
|
|
|
3. Нахождение в природе.
Содержание кремния в земной коре составляет по разным данным 27,6—29,5 % по массе. Таким образом, по распространённости в земной коре кремний занимает второе место после кислорода. Концентрация в морской воде 3 мг/л. Соединения кремния содержатся в организмах растений и животных.
Чаще всего в природе кремний встречается в виде кремнезёма — соединений на основе диоксида кремния (IV) SiO2 (около 12 % массы земной коры). Основные минералы и горные породы, образуемые диоксидом кремния — это песок (речной и кварцевый), кварц и кварциты, кремень, полевые шпаты. Природные силикаты имеют сложный состав и строение. Вот состав некоторых природных силикатов:
ü полевой шпат К2О× Аl2O3× 6SiO2,
ü асбест 3MgО× 2SiO2× 2H2O,
ü cлюда К2О× 3Аl2O3× 6SiO2× 2H2O,
ü каолинит 3Аl2O3× 2SiO2× 2H2O.
Вторую по распространённости в природе группу соединений кремния составляют силикаты и алюмосиликаты.
Отмечены единичные факты нахождения чистого кремния в самородном виде.
4. Химические свойства кремния и его соединений.
По химическим свойствам кремний, как и углерод, является неметаллом, но его неметалличность выражена слабее, так как он имеет больший атомный радиус. Поскольку у атомов кремния на внешнем энергетическом уровне находится 4 электрона, то для кремния характерна степень окисления как -4, так и +4 (известно соединение кремния, где его степень окисления равна +2).
Кремний при обычных условиях довольно инертен, что следует объяснить прочностью его кристаллической решетки. Непосредственно он взаимодействует только со фтором:

Кислоты (кроме смеси плавиковой HF и азотной HNO3) на кремний не действуют. Однако он растворяется в гидроксидах щелочных металлов, образуя силикат и водород:
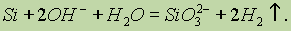
Из двух аллотропных модификаций кремния — кристаллической и аморфной — химически более активным является аморфный кремний. Он реагирует с кислородом при нагревании, образуя SiO2:
|
|
|

а также со всеми галогенами, например:

При высокой температуре кремний соединяется с углеродом, образуя карборунд SiC:

Карборунд имеет алмазоподобную кристаллическую решетку, в которой каждый атом кремния окружен четырьмя атомами углерода и наоборот, а ковалентные связи очень прочны, как в алмазе. Поэтому по твердости он близок к алмазу. Из карбида кремния изготовляют точильные камни и шлифовальные круги.
Силицид магния. В реакциях с активными металлами, протекающих с образованием силицидов, кремний выступает в роли окислителя:

При высоких температурах кремний восстанавливает многие металлы из их оксидов.(!!!)
Силан. При действии на силициды соляной кислоты получают простейшее водородное соединение кремния силан SiH4:
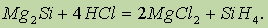
Силан — ядовитый газ с неприятным запахом, самовоспламеняется на воздухе(!!!):

Оксид кремния (IV). Оксид кремния (IV) называют также кремнеземом. Это твердое тугоплавкое вещество (температура плавления 1700°С), широко распространенное в природе в двух видах:
1) кристаллический кремнезем — в виде минерала кварца и его разновидностей (горный хрусталь, халцедон, агат, яшма, кремень); кварц составляет основу кварцевых песков, широко используемых в строительстве и в силикатной промышленности;
2) аморфный кремнезем — в виде минерала опала состава SiO2× п H2O; землистыми формами аморфного кремнезема являются диатомит, трепел (инфузорная земля); примером искусственного аморфного безводного кремнезема может служить силикагель, который получается из метасиликата натрия:

Силикагель имеет развитую поверхность, а поэтому хорошо адсорбирует влагу.
При 1710° кварц плавится. При быстром охлаждении расплавленной массыобразуется кварцевое стекло. Оно имеет очень малый коэффициент расширения, благодаря чему раскаленное кварцевое стекло не трескается при быстром охлаждении водой. Из кварцевого стекла изготовляют лабораторную посуду и приборы для научных исследований.
Простейшая формула оксида кремния (IV) SO2 аналогична формуле оксида углерода (IV) СO2. Между тем физические свойства их резко отличаются (SiO2 — твердое вещество, CO2 — газ). Это различие объясняется строением кристаллических решеток. С02 кристаллизуется в молекулярной решетке, SiO2 — в атомной. Структуру SiO2 в плоскостном изображении можно представить так:
|
|
|
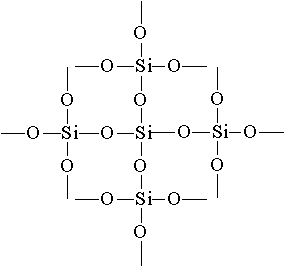
Координационное число атома углерода в твердом СO2 равно 2, а кремния в SiO2 равно 4. Каждый атом кремния заключен в тетраэдр из 4 атомов кислорода. При этом атом кремния находится в центре, а по вершинам тетраэдра расположены атомы кислорода. Весь кусок кремнезема можно рассматривать как кристалл, формула которого (SiO2)n. Такое строение оксида кремния (IV) обусловливает его высокую твердость и тугоплавкость.
По химическим свойствам оксид кремния (IV) SiO2 относится к кислотным оксидам. При сплавлении его с твердыми щелочами, основными оксидами и карбонатами образуются соли кремниевой кислоты:

С оксидом кремния (IV) взаимодействует только плавиковая кислота:
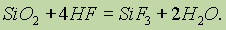
С помощью этой реакции производится травление стекла.
В воде оксид кремния (IV) не растворяется и с ней химически не взаимодействует.(!!!) Поэтому кремниевую кислоту получают косвенным путем, действуя кислотой на раствор силиката калия или натрия:

При этом кремниевая кислота(в зависимости от концентрации исходных растворов соли и кислоты) может быть получена как в виде студнеобразной массы, содержащей воду, так и в виде коллоидного раствора (золя).
Кремниевые кислоты. SiO2 является ангидридом ряда кремниевых кислот, состав которых можно выразить общей формулой: xSiO2 × yH2O, где х и у — целые числа:
1) х = 1, у = 1: SiO2 × H2O, т. е. H2SiO3 — метакремниевая кислота;
2) х = 1, у = 2: SiO2 × 2H2O, т. е. H4SiO4 — ортокремниевая кислота;
3) х = 2, у = 1: 2SiO2 × H2O, т. е. H2Si2O5 — двуметакремниевая кислота.
Кремниевая кислота построена из тетраэдрических структурных звеньев (в каждом таком звене атом кремния находится в центре тетраэдра, а по вершинам расположены атомы кислорода). Структурные звенья, объединяясь в цепи, образуют более устойчивые поликремниевые кислоты:
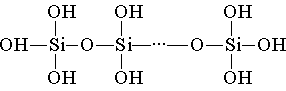
Состав такого соединения можно выразить формулой (H2SiO3)n. Однако обычно кремниевую кислоту изображают формулой H2SiO3. H2SiO3 — кислота очень слабая, в воде мало растворима. При нагревании легко распадается аналогично угольной кислоте:
|
|
|

Все кремниевые кислоты очень слабые (слабее угольной).
Силикаты. Соли всех кремниевых кислот называют силикатами, хотя, как правило, в учебной литературе под силикатами подразумевают соли метакремниевой кислоты. Их состав обычно изображают формулой в виде соединений оксидов элементов. Например, силикат кальция CaSiO3 можно выразить так: СаО× SiO2.
Силикаты состава R2О× nSiO2, где R2O — оксиды натрия или калия, называются растворимым стеклом, а их концентрированные водные растворы — жидким стеклом. Наибольшее значение имеет натриевое растворимое стекло.
При стоянии на воздухе растворы силикатов мутнеют, так как находящийся в воздухе оксид углерода (IV) вытесняет кремниевую кислоту из ее солей:
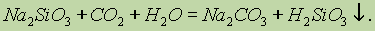
Кремниевая кислота практически нерастворима в воде — это свойство используют как качественную реакцию на ион SiO32- .
Силикаты получают сплавлением оксида кремния с щелочами или карбонатами:

5. Открытие иона SiO32-.(не могу найти ничего…)
6. Роль соединений кремния в почвообразовании и лесном хозяйстве.
Магматические породы по своему составу достаточно стабильны и содержат главным образом соединения кремния, алюминия, железа, щелочей, магния и кальция. По содержанию Si02 магматические породы подразделяются на четыре группы: кислые (>65%), средние (52 — 65%), основные (40—52%) и ультраосновные (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Кислые магматические породы — граниты, пегматиты, риолиты, дацит и другие — обычно имеют светлую и буроватую окраску с выраженными кристаллами кварца, полевых шпатов, слюд. Содержание SiО2 в них высокое (более 65 %) при заметном количестве калия и натрия. В то же время железа немного, а кальция и магния ничтожно мало. Почвы на кислых магматических породах, например на гранитах, отличаются на ранних стадиях выветривания рыхлостью, гравийным характером исходного материала. При выветривании в гумидных условиях они легко теряют щелочноземельные элементы, вследствие чего почвы на таких выветрелых субстратах (элювии пород) чрезвычайно бедные, малоплодородные.
Основные магматические породы — базальт, габбро и др., как правило, имеют темную (до черной) окраску. Для них характерно более низкое по сравнению с кислыми породами содержание SiO2. Основные магматические породы относительно богаты соединениями железа, марганца, хрома, кобальта, цинка, титана, никеля, меди. Продукты их выветривания довольно быстро приобретают глинистый характер, длительно сохраняют щелочную и нейтральную реакцию, отличаются повышенным содержанием гумуса и глинистых минералов. Почвы на таких породах более плодородны.
|
|
|
Кроме кислых и основных пород нередко встречаются магматические породы переходного типа (средние) — интрузивные породы группы диорита и их эффузивные аналоги — андезиты. Соответственно и почвы на этих породах приобретают черты, сходные с почвами, приуроченными к кислым или основным породам. Значительно реже распространены ультраосновные породы: перидотиты и пикриты, у которых содержание Si02 самое низкое.
Метаморфические породы — переходные между массивно-кристаллическими и осадочными породами. Древние осадочные породы при погружении, высоком давлении и температурах метаморфизируются, образуя гнейсы, серпентиниты, мрамор, кварциты, глинистые сланцы. Гнейсы по своему составу особенно близки к гранитам. Почвы, формирующиеся на таких породах, имеют сходные черты с почвами на собственно кислых магматических породах.
Хлор.
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Хлор - элемент главной подгруппы VII группы, 3-его периода, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов.
Простое вещество хлор при нормальных условиях — ядовитый газ желтовато-зелёного цвета тяжелее воздуха, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Основное состояние: +17Cl17е 1s22s22p63s23p5 , р-элемент. Ст.ок.: -1 +1 +3 +5 +7.
Строение электронной оболочки.
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1s2 2s2 2p6 3s2 3p5, поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие степени окисления. Схема образования возбуждённых состояний атома:
| Валентность | Возможные степени окисления | Электронное состояние валентного уровня | Пример соединений |
| I | +1, −1 | 1s2 2s2 2p6 3s2 3p5 | NaCl, NaClO |
| III | +3 | 1s2 2s2 2p6 3s2 3p4 3d1 | NaClO2 |
| V | +5 | 1s2 2s2 2p6 3s2 3p3 3d2 | KClO3 |
| VII | +7 | 1s2 2s2 2p6 3s1 3p3 3d3 | KClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO2 и Cl2O6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
2. Физические свойства.
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Некоторые его физические свойства представлены ниже.
Плотность: 3,214 г/л, жид.- при -35 0С – 1,557, тв. при -105 0С- 1,9 г/см3.
Температура плавления: 172,2 К
Температура кипения: 238,6 К
Теплота плавления: 6,41 кДж/моль
Теплота испарения: 20,41 кДж/моль.
Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа. По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
3. Нахождение в природе.
В природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген . Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов:
ü галита NaCl,
ü сильвина KCl,
ü сильвинита KCl · NaCl,
ü бишофита MgCl2 · 6Н2О,
ü карналлита KCl · MgCl2 · 6Н2O,
ü каинита KCl · MgSO4 · 3Н2О.
Самые большие запасы хлора содержатся в составе солей, вод, морей и океанов (содержание в морской воде 19 г/л). На долю хлора приходится 0,024% от общего числа атомов земной коры; кларковое число (числа, выражающие среднее содержание химических элементов в земной коре, гидросфере, Земле, космических телах, геохимических или космохимических системах и др., по отношению к общей массе этой системы. Выражается в % или г/кг.) хлора – 0,017%. Человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
4. Химические свойства хлора и его соединений. Получение хлора.
|
|
|


