 |
Уравнения изопроцессов и постоянная адиабаты
|
|
|
|
ВВЕДЕНИЕ
Термодинамический процесс представляет собой переход газа из одного состояния в другое, характеризуемое иным, по сравнению с исходным, значением термодинамических параметров. Среди огромного многообразия процессов особое значение имеют так называемые изопроцессы, т.е. процессы, в которых один из параметров состояния остается неизменным. К таким процессам относятся: изобарический, изохорический, изотермический и адиабатический процессы.
Целью настоящей работы является изучение изохорного, изотермического и адиабатного процессов.
Уравнения изопроцессов и постоянная адиабаты
Состояния большинства реальных газов при давлениях от атмосферного и ниже удовлетворительно описываются уравнением состояния идеального газа (уравнение Менделеева-Клайперона):
 (1.1)
(1.1)
где р — давление, V - объем, М - масса газа,  - молярная масса, Т - температура, R - газовая постоянная. Рассмотрим изопроцессы идеального газа. В условиях постоянства температуры связь между давлением и объемом дается соотношением:
- молярная масса, Т - температура, R - газовая постоянная. Рассмотрим изопроцессы идеального газа. В условиях постоянства температуры связь между давлением и объемом дается соотношением:
pV = const (1.2)
Или, разрешая (1.2) относительно р, получаем р = С/V, где С = (М/ 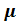 )RТ - константа. Изучая в реальном эксперименте зависимость р от V в условиях, когда постоянство температуры обеспечено, можно не только убедиться в характере зависимости, но и, зная температуру, оценить количество вещества. Необходимым условием осуществления изотермического процесса является его медленное протекание, ибо только при этом условии возможно установление теплового равновесия между рабочим газом и окружающей средой, т.е., установление равенства температур между ними.
)RТ - константа. Изучая в реальном эксперименте зависимость р от V в условиях, когда постоянство температуры обеспечено, можно не только убедиться в характере зависимости, но и, зная температуру, оценить количество вещества. Необходимым условием осуществления изотермического процесса является его медленное протекание, ибо только при этом условии возможно установление теплового равновесия между рабочим газом и окружающей средой, т.е., установление равенства температур между ними.
При изохорном процессе изменение состояния газа происходит при постоянном объеме (V = const => dV=0 => dA=pdV=0). В этом случае, при неизменном количестве газа, связь между давлением и температурой определяется уравнением:
|
|
|
 (1.3)
(1.3)
Признаком адиабатического процесса является, как известно, отсутствие теплообмена с окружающей средой. Поэтому первое начало термодинамики dQ = dU + pdV может быть записано следующим образом:
0 = dU + pdV (1.4)
где dU – изменение внутренней энергии газа.
Используя величину CV — молярную теплоемкость при постоянном объеме, уравнение (1.4) можно переписать
0 = v CV dT + p dV (1.5)
где 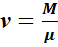 — число молей вещества, Выражение (1.5) представляет собой дифференциальное уравнение, для решения которого необходимо выполнить известную процедуру разделения переменных. для этого выразим р из уравнения состояния, подставим в (1.5) и поделим уравнение на Т:
— число молей вещества, Выражение (1.5) представляет собой дифференциальное уравнение, для решения которого необходимо выполнить известную процедуру разделения переменных. для этого выразим р из уравнения состояния, подставим в (1.5) и поделим уравнение на Т:
 (1.6)
(1.6)
После деления (1.6) на CV, приводим уравнение к виду
 (1.7)
(1.7)
Интегрирование уравнения дает соотношение
 (1.8)
(1.8)
С учетом известного уравнения Майера Сp = СV + R, а также используя коэффициент Пуассона g = Cp / CV, получаем уравнение адиабаты (уравнение Пуассона) в виде
TV g-1 = const (1.9)
Выражая Т из (1.1) и подставляя в (1.9), получаем уравнение Пуассона в переменных р, V
pV g = const (1.10)
Изучая зависимость между переменными р, V в адиабатическом процессе, можно определить коэффициент Пуассона γ (показатель адиабаты), который, как известно, связан с числом степеней свободы i молекулы газа соотношением
 (1.11)
(1.11)
Знание i позволяет судить о конфигурации молекулы газа. Необходимым условием осуществления адиабатического процесса является его быстрое протекание, поскольку в этом случае теплообмен между газом и окружающей средой не успевает произойти, и таким образом выполняется условие теплоизоляции.
Уравнения (1.2) и (1.10) могут быть обобщены в виде уравнения
pV n = const (1.12)
где n принимает значения от 1 γ.
Процесс, описываемый уравнением (1.12) с любым постоянным показателем степени n называется политропным процессом, характеризуемым постоянством теплоемкости.
|
|
|
Рассмотрим метод определения γ используемый в данной работе (метод Клемана-Дезорма). Исследования адиабатического расширения газа, в данном методе удобно проводить в переменных P и T. Вначале в рабочий объем нагнетается воздух. Вследствие этого воздух нагревается. Далее происходит изохорическое остывание газа до температуры окружающей среды. После установления термодинамического равновесия с окружающей средой в рабочем объеме устанавливается состояние газа характеризуемое температурой Т 1 равной температуре окружающей среды и давлением P 1, которое превышает атмосферное давление P 0 на небольшую величину P ′, т.е. P 1 = P 0 + P ′ и P ′ << P 0. На короткое время откроем и закроем кран соединяющий рабочий объем с окружающей средой. После открытия крана давление упадет до атмосферного, а температура понизится ниже комнатной вследствие расширения газа. Это процесс можно считать адиабатным, если за время открытия крана теплообменом с окружающей средой можно пренебречь. В этом состоянии система будет характеризоваться давлением P 2 = P 0 и температурой T 2 которая будет ниже комнатной T 1 (температура понижается, поскольку расширение происходит за счет внутренней энергии газа). Преобразовав уравнение адиабаты (1.10) с помощью уравнения Менделеева-Клайперона (1.1) к переменным P и T получим:
 (1.13)
(1.13)
После закрытия крана происходит медленное изохорическое нагревание системы через стенки сосуда до температуры окружающей среды T 1. Вследствие нагрева давление в системе будет возрастать и установится какое-то давление P 3 = P 0 + P ″. Причем P ″ << P 0. Изохорический процесс выравнивания температуры подчиняется закону Гей-Люссака:
 (1.14)
(1.14)
Исключая с помощью (1.14) отношение температур T 1/ T 2 из (1.13), найдем

Отсюда, учитывая, что P 2 = P 0, находим γ
 (1.15)
(1.15)
В нашем случае давления P 1 и P 3 отличаются от атмосферного на малые величины P ′ и P ″, соответственно. Разлагая логарифмы в ряд по малому параметру и пренебрегая членами второго и более высоких порядков малости в выражении 1.15, получим:
 (1.16)
(1.16)
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
|
|
|


