 |
Восстановительные свойства водорода
|
|
|
|
КИСЛОРОД
Получение кислорода.
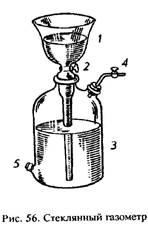
Для собирания и хранения газов применяют стеклянные газометры (рис. 56). Умеренно растворимые в воде газы, в том числе и кислород, собирают и хранят в них над водой. Газометр состоит из двух частей: воронки 1, снабженной краном 2, и толстостенной склянки 3 с отверстием для выхода газа 4 и сливным отверстием 5 внизу для воды.
Заполнение газометра водой. Снять воронку 1 и заполнить водой склянку 3. Перевернуть воронку 1 трубкой вверх, закрыть кран 2, заполнить водой трубку воронки, снова перевернуть воронку трубкой вниз, закрыв отверстие ее большим пальцем. Быстро погрузить воронку в склянку 3, наполненную доверху водой. Если в газометре остались пузырьки воздуха, то их следует удалить через кран 2, пользуясь металлической проволочкой или легким покачиванием газометра.
Поставить заполненный водой газометр на край стола около водопроводной раковины. Закрыв все краны газометра, открыть нижнее его отверстие 5. Выливается ли вода из газометра?
Заполнение газометра кислородом. Измерить объем газометра. Написать уравнение разложения перманганата калия. Рассчитать, сколько граммов соли следует взять, чтобы выделившийся при этом кислород заполнил газометр на 2/3.
Взвесить нужное количество перманганата калия, перенести его в колбу Вюрца, снабженную резиновой трубкой, и укрепить колбу в штативе.
Нагреть колбу с перманганатом калия и, подождав, пока вытеснится воздух из колбы и газоотводной трубки, ввести газоотводную трубку в сливное отверстие газометра. Вытекающая вода должна сливаться в раковину. Заполнив газометр кислородом (на 2/3), вынуть газоотводную трубку и закрыть сливное отверстие пробкой. Следить за тем, чтобы воронка 1 была наполнена водой. После того как газ в газометре охладиться до комнатной температуры, открыть на короткое время кран 2 (для чего?).
|
|
|
В каких условиях может быть получен кислород из пероксида бария и бертолетовой соли? Напишите уравнения реакций.
Получение тока кислорода из газометра. Чтобы наполнить сосуд кислородом, необходимо налить в него до краев воду, закрыть пластинкой, смазанной тонким слоем вазелина, перевернуть и погрузить сосуд в ванну с водой. Опустить газоотводную трубку от газометра в ванну и, открыв краны 2 и 4, отрегулировать скорость подачи кислорода; она должна быть такой, чтобы можно было легко считать пузырьки газа. Подвести газоотводную трубку под отверстие сосуда, заполненного водой. Когда сосуд будет почти наполнен кислородом, закрыть его под водой стеклянной пластинкой и вынуть из воды.
Свойства кислорода.
1. Положить в ложечку для сжигания кусочек серы величиной с горошину, поджечь ее на пламени горелки (под тягой!). Обратить внимание на цвет и размер пламени горящей серы. Внести горящую серу в банку с кислородом. Какие изменения в горении серы наблюдаются?
2. Положить в ложечку для сжигания небольшой кусочек древесного угля, накалить и внести в банку с кислородом. Как изменяется интенсивность горения угля в кислороде?
3. Свернуть спиралью отрезок стальной проволоки и прикрепить его к концу ложечки для сжигания. Присоединить к проволоке кусочек корковой пробки. Поджечь пробку и быстро внести проволоку в банку с кислородом. Что происходит? Написать уравнение реакции в молекулярной и электронной формах.
Какой вывод о свойствах кислорода можно сделать на основании проведенных опытов? Как влияет на интенсивность горения веществ замена воздуха кислородом? Чем это объясняется? Почему у кислорода низкие температуры плавления и кипения? Какое строение имеет молекула озона?
|
|
|
ВОДОРОД
Работа с водородом требует большой осторожности! Водород горюч и в смеси с кислородом или воздухом образует взрывчатую смесь. Все опыты в атмосфере водорода разрешается проводить только в присутствии преподавателя! Надевать очки или маску.
Если водород необходимо нагревать в приборе или пожечь при выходе из него, следует до опыта вытеснить из прибора весь воздух, затем проверить водород на чистоту (в присутствии преподавателя). Для этого приготовить 2 пробирки. Надеть на газоотводную трубку сухую пробирку, через 5–10 с медленно снять ее, закрыв отверстие пробирки большим пальцем, и поставить на ее место вторую. Поднести заполненную водородом пробирку, перевернутую вверх дном, к пламени горелки. Отняв палец, пожечь водород. Производить, меняя пробирку, проверку чистоты выделяющегося водорода до тех пор, пока собранный газ не будет загораться почти без звука.
Только убедившись в чистоте выделяющегося водорода, можно поджечь его горящей лучинкой у отверстия прибора, из которого он выделяется, или начать нагревание прибора (в присутствии преподавателя!).
При проведении реакций в атмосфере водорода в нагреваемом приборе разрешается прекращать поступление тока водорода только тогда, когда нагреваемая реакционная часть прибора примет температуру, близкую к комнатной.
Получение водорода.
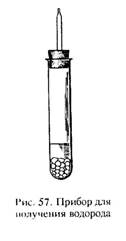
Действие металла на кислоту. Собрать прибор (рис. 57). Поместить в пробирку 5–8 кусочков гранулированного цинка, прилить 5 мл 20 %-го раствора серной кислоты и закрыть отверстие пробирки пробкой с газоотводной трубкой, оттянутой вверху. Проверить водород на чистоту.
Убедившись в чистоте выделяющегося водорода, поджечь его горящей лучинкой у отверстия газоотводной трубки. Опрокинуть над пламенем водорода холодную стеклянную воронку. Что наблюдается? Написать уравнение реакции в молекулярной и электронно-ионной формах.
Действие алюминия на щелочь. (Вытяжной шкаф, надеть очки!) Положить в пробирку несколько кусочков алюминия, прилить к ним 2–3 мл 20 %-го раствора гидроксида натрия. Если реакция идет плохо, осторожно подогреть. Определить, какой газ выделяется. Написать уравнение реакции в молекулярной и электронно-ионной формах.
|
|
|
Действие металла на воду.
1. Заполнить пробирку до краев водой. Закрыв отверстие большим пальцем, опрокинуть ее в ванну с водой и в таком положении закрепить в лапке штатива. Завернуть несколько кусочков металлического кальция в марлю и быстро при помощи щипцов подвести металл под пробирку. Определить, какой газ выделяется. Написать уравнение реакции в молекулярной и электронно-ионной формах.
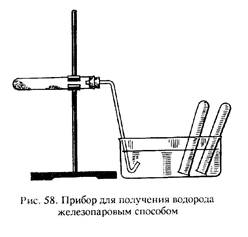
2. Собрать прибор (рис. 58). На дно сухой пробирки насыпать небольшое количество влажного речного песка, следя за тем, чтобы стенки пробирки оставались сухими. Закрепить пробирку в штативе так, чтобы дно было немного ниже отверстия. Сделав из узкой полоски бумаги желобок, насыпать порошок восстановленного железа в среднюю часть пробирки. Закрыть пробирку пробкой с газоотводной трубкой. Сильно нагреть пробирку пламенем газовой горелки в том месте, где лежит железо. Пламенем второй горелки осторожно нагреть влажный песок. Собрать выделяющийся газ над водой и испытать его воспламеняемость. Написать уравнения реакций в молекулярной и электронно-ионной формах.
Восстановительные свойства водорода
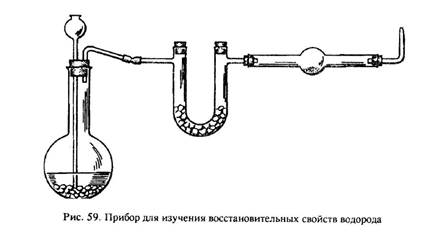
Восстановление оксида металла. (Надеть очки!) Собрать прибор (рис. 59) и проверить его герметичность. В колбу Вюрца емкостью 250 мл поместить 40–50 кусочков гранулированного цинка. В U-образную трубку насыпать безводный хлорид кальция. В расширенную часть тугоплавкой трубки поместить 0,3 г оксида меди (II), в выводящую водород газоотводную трубку положить кусочек медной сетки или фольги. Налить в колбу 100–150 мл 20 %-го раствора серной кислоты. Вновь проверить герметичность прибора. Проверить чистоту выделяющегося водорода. Убедившись в чистоте водорода, поджечь спичкой водород у выходного отверстия прибора. Прогреть осторожно реакционную трубку по всей длине, а затем сильно нагреть ту часть трубки, где находится оксид меди (II). Следить за тем, чтобы пламя горящего водорода сильно не уменьшалось. Если пламя погаснет, прекратить нагревание.
Когда восстановление закончится (как это установить?), прекратить нагревание и охладить прибор до комнатной температуры в токе водорода. Восстановленную медь сдать преподавателю. Непрореагировавший цинк промыть водой и сдать лаборанту.
|
|
|
Пероксид водорода
Получение пероксида водорода.
В колбу емкостью 50 мл налить 20 мл 5 %-го раствора серной кислоты и охладить ее до 0 °С. Взбалтывая содержимое колбы в течение 5-10 мин, всыпать в нее небольшими порциями около 1 г пероксида бария. Полученный раствор пероксида водорода отфильтровать от осадка. Изучить свойства пероксида водорода.
Свойства пероксида водорода.
1. В пробирку с раствором пероксида водорода внести оксид марганца (IV). Какой газ выделяется? Какую роль играет оксид марганца (IV)? Написать уравнение реакции.
2. К раствору пероксида водорода прилить несколько капель раствора йодида калия. Что наблюдается? Разбавить раствор водой и внести в него 1-2 капли раствора крахмала. Что происходит? Написать уравнение реакции в молекулярной и электронно-ионной формах.
3. Получить осадок сульфида свинца взаимодействием растворов соли свинца и сульфида натрия. Небольшое количество осадка, промытого водой путем декантации, обработать раствором пероксида водорода. Почему изменился цвет осадка? Написать уравнения реакций. Какие свойства проявляет пероксид водорода в этой и предыдущей реакциях?
4. К раствору перманганата калия, подкисленному серной кислотой, прилить раствор пероксида водорода. Что наблюдается? Написать уравнение реакции в молекулярной и электронно-ионной формах. На какие свойства пероксида водорода указывает эта реакция?
 |
|

|
|
|


