 |
Буферные системы: классификация, состав, свойства
|
|
|
|
59. БУФЕРНЫЕ СИСТЕМЫ ПОДДЕРЖИВАЮТ ПОСТОЯНСТВО
1. рН
2. концентрации ионов H+
3. концентрации ионов OH-
4. верны ответы 1 и 2
5. верны ответы 1, 2, 3
60. ИЗ ДВУХ СОЛЕЙ СОСТОИТ БУФЕРНАЯ СИСТЕМА
1. ацетатная
2. фосфатная
3. аммиачная
4. бикарбонатная
5. гемоглобиновая
61. ОДНОКОМПОНЕНТНОЙ МОЖЕТ БЫТЬ БУФЕРНАЯ СИСТЕМА
1. белковая
2. ацетатная
3. фосфатная
4. аммиачная
5. гидрокарбонатная
62. [H+] В КИСЛОТНОЙ БУФЕРНОЙ СИСТЕМЕ РАССЧИТЫВАЕТСЯ ПО УРАВНЕНИЮ
1. 
2. 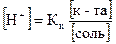
3. 
4. 
5. 
63. рН КИСЛОТНОЙ БУФЕРНОЙ СИСТЕМЫ РАССЧИТЫВАЕТСЯ ПО УРАВНЕНИЮ
1. 
2. 
3. 
4. 
5. 
64. рН ОСНОВНОЙ БУФЕРНОЙ СИСТЕМЫ РАССЧИТЫВАЕТСЯ ПО УРАВНЕНИЮ
1. 
2. 
3. 
4. 
5. 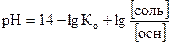
65. ПРИ ДОБАВЛЕНИИ СИЛЬНОЙ КИСЛОТЫ К АЦЕТАТНОМУ БУФЕРНОМУ РАСТВОРУ ПРОТЕКАЕТ ПРОЦЕСС
1. CH3COO- + HCl = CH3COOH + Cl-
2. CH3COONa + H+ = CH3COOH + Na+
3. CH3COONa + HCl = CH3COO- + H+ + Na+ + Cl-
4. CH3COO- + Na+ + Н + + Cl- = CH3COOH + NaCl
5. CH3COO-+ Na+ + H++ Cl- = CH3COOH + Na+ + Cl-
66. ПРИ ДОБАВЛЕНИИ ЩЕЛОЧИ К АЦЕТАТНОМУ БУФЕРНОМУ РАСТВОРУ ПРОТЕКАЕТ ПРОЦЕСС
1. CH3COOH + NaOH = CH3COO- + Na+ + H2O
2. CH3COOH + Na+ + OH- = CH3COO- + Na+ + H2O
3. CH3COOH + Na+ + OH- = CH3COO- + Na+ + H+ + OH-
4. CH3COO- + H+ + NaOH = CH3COO- + Na+ +H2O
5. CH3COO- + H+ +Na+ + OH- = CH3COO- + Na+ + H+ + OH-
67. ПРИ ДОБАВЛЕНИИ СИЛЬНОЙ КИСЛОТЫ К АММИАЧНОМУ БУФЕРНОМУ РАСТВОРУ ПРОТЕКАЕТ ПРОЦЕСС
1. NH4OH + H + + Cl- = NH4Cl + H2O
2. NH4OH + H+ +Cl- = NH4+ + Cl- + H2O
3. NH4OH + H+ + Cl- = NH4+ + Cl- + H+ + OH-
4. NH4+ + OH- + H + + Cl- = NH4+ + Cl-+ H2O
5. NH4+ + OH- + H+ + Cl- = NH4+ + Cl- + H+ + OH-
68. ПРИ ДОБАВЛЕНИИ ЩЕЛОЧИ К АММИАЧНОМУ БУФЕРНОМУ РАСТВОРУ ПРОТЕКАЕТ ПРОЦЕСС
1. NH4Cl + NaOH = NH4+ + OH- + Na+ + Cl-
2. NH4Cl + Na+ + OH- = NH4OH + Na+ + Cl-
3. NH4+ + Cl- + NaOH = NH4OH + Na+ + Cl-
4. NH4+ + Cl- + Na+ + OH- = + + OH- + Na+ + Cl-
5. NH4+ + Cl- + Na+ + OH- = NH4OH + Na+ + Cl-
69. БУФЕРНАЯ ЁМКОСТЬ РАССЧИТЫВАЕТСЯ ПО ФОРМУЛЕ
1. 
2. 
3. 
4. 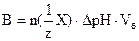
5. 
70. БУФЕРНАЯ ЕМКОСТЬ ЗАВИСИТ
1. от количества добавленных кислот и щелочей
2. от концентрации компонентов буферного раствора
|
|
|
3. от отношения концентраций компонентов буферного раствора
4. верны ответы 1 и 2
5. верны ответы 2 и 3
РАЗДЕЛ 7.
РОЛЬ БУФЕРНЫХ СИСТЕМ В ОРГАНИЗМЕ ЧЕЛОВЕКА
71. рН КРОВИ В НОРМЕ НАХОДИТСЯ В ПРЕДЕЛАХ
1. 7,41 ± 0,05
2. 7,40 ± 0,05
3. 7,38 ± 0,05
4. 7,37 ± 0,05
5. 7,36 ± 0,05
72. В СОСТАВ КРОВИ НЕ ВХОДИТ БУФЕРНАЯ СИСТЕМА
1. белковая
2. ацетатная
3. фосфатная
4. гемоглобиновая
5. гидрокарбонатная
73. ФОСФАТНАЯ БУФЕРНАЯ СИСТЕМА КРОВИ ИМЕЕТ СОСТАВ
1. H2PO4- / PO43-
2. H2PO4- / НРО42-
3. H3PO4 / H2PO4-
4. H3PO4 / Na2HPO4
5. H3PO4 / NaH2PO4
74. НАИБОЛЬШЕЙ БУФЕРНОЙ ЕМКОСТЬЮ В ПЛАЗМЕ КРОВИ ОБЛАДАЕТ БУФЕРНАЯ СИСТЕМА
1. белковая
2. фосфатная
3. гемоглобиновая
4. гидрокарбонатная
5. оксигемоглобиновая
75. СИСТЕМА ГЕМОГЛОБИН-ОКСИГЕМОГЛОБИН
1. находится в эритроцитах
2. участвует в процессе дыхания
3. участвует в поддержании рН крови
4. верны ответы 1 и 3
5. верны ответы 1, 2, 3
76. ПОСТОЯНСТВО РН РАЗЛИЧНЫХ СРЕД И ТКАНЕЙ ЧЕЛОВЕЧЕСКОГО ОРГАНИЗМА НАЗЫВАЕТСЯ
1. равновесным состоянием
2. стационарным состоянием
3. кислотно-основным состоянием
4. ионным гомеостазом
5. концентрационным гомеостазом
77. ЩЕЛОЧНОЙ РЕЗЕРВ КРОВИ У ЧЕЛОВЕКА В НОРМЕ, В ОБЪЕМНЫХ ПРОЦЕНТАХ, РАВЕН
1. 40 – 50
2. 40 – 60
3. 50 – 60
4. 50 – 70
5. 60 – 70
78. КОРРЕКЦИЯ КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ ПРИ АЦИДОЗЕ (рН < 7,35) МОЖЕТ ПРОВОДИТЬСЯ РАСТВОРОМ
1. HCl
2. H2SO4
3. NaOH
4. Na2CO3
5. NaHCO3
79. КОРРЕКЦИЯ КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ ПРИ АЛКАЛОЗЕ (рН > 7,45) МОЖЕТ ПРОВОДИТЬСЯ РАСТВОРОМ
1. HCl
2. H2SO4
3. NaOH
4. Na2CO3
5. NaHCO3
80. ИЗБЫТОК КИСЛОТ В ОРГАНИЗМЕ ГИДРОКАРБОНАТНАЯ БУФЕРНАЯ СИСТЕМА НЕЙТРАЛИЗУЕТ ПО УРАВНЕНИЮ
1. CO32- + H+ = HCO3-
2. СО32- + 2Н+ = Н2СО3
3. НСО3- + Н+ = Н2СО3
4. НСО3- + НCl = Н2СО3 + Cl-
5. Na2CO3 + 2HCl = H2CO3 + 2NaCl
81. ИЗБЫТОК ОСНОВАНИЙ В ОРГАНИЗМЕ ФОСФАТНАЯ БУФЕРНАЯ СИСТЕМА НЕЙТРАЛИЗУЕТ ПО УРАВНЕНИЮ
1. HPO42- + OH- = PO43- + H2O
2. Н2РО4- + OН- = НРО42- + H2O
3. H3PO4 + OH- = H2PO4- + H2O
4. H3PO4 + NaOH = NaH2PO4 + H2O
|
|
|
5. Na2HPO4 + NaOH = Na3PO4 + H2O
МОДУЛЬ 2. БИОЛОГИЧЕСКИ ВАЖНЫЕ ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ И СОЕДИНЕНИЯ. ФИЗИКО-ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ И РАСТВОРОВ ВМС
РАЗДЕЛ 1.
|
|
|


