 |
Элементы VI А группы (халькогены).
|
|
|
|
Тесты по химии.
Водород.
1.1. Выберите верное утверждение:
1) атом водорода имеет наименьший среди атомов всех элементов радиус;
2) водород является наименее электроотрицательным элементом;
3) водород является единственным неметаллом среди s-элементов;
4) молекулярный водород растворяется в некоторых металлах.
1.2. Укажите правильное утверждение для бинарных соединений водорода с неметаллами:
1) состав выражается формулой ЭНх (где х – номер группы, в которой расположен элемент Э);
2) состоят только из полярных молекул;
3) могут быть получены в реакциях ионного обмена;
4) как правило, неограниченно растворимы в воде.
1.3. Одинаковую степень окисления имеют атомы водорода во всех соединениях, формулы которых приведены в ряду:
1) NH3, CH4, SiH4
2) BeH2, CaH2, GeH4
3) SnH4, H2Se, HBr
4) CaH2, C2H2, HI.
1.4. Укажите все типы химических связей и межмолекулярных взаимодействий, встречающихся в водородсодержащих соединениях:
1) ионная связь;
2) водородная связь;
3) ковалентная полярная связь;
4) ковалентная неполярная связь.
1.5. Не физические, а химические свойства водорода являются определяющими при использовании его:
1) для очистки нефти от серы;
2) в воздухоплавании;
3) в качестве хладагента;
4) для быстрого отвода тепла.
1.6. При каком взаимодействии (процессе) не образуется молекулярный водород:
1) Si + NaOH (р-р)
2) CaH2 + H2O
3) Zn + KHSO4 (р-р)
4) электролиз расплава KOH.
1.7. Электронная конфигурация атома водорода
1)1s2
2) 1s1
3) 2s2
4) 2s1
1.8. Во сколько раз водород легче воздуха:
1) в 29 раз
2) в 16 раз
3) в 32 раза
4) в 14,5 раза
1.9. Массовая доля воды в составе медного купороса равна:
1) 3,6%
2) 0,036%
3) 36%
4) 64%
1.10. Со всеми веществами, каких рядов реагирует вода:
|
|
|
1) CO2, Na2O, CH3OH
2) Fe, Cl2, SO3
3) O2, F2, C
4) H2, NaOH, NaCl
Элементы VII А группы (галогены).
2.1. Электроотрицательность какого галогена наименьшая:
1) F
2) Br
3) Cl
4) I
2.2. В каком ряду галогены расположены в порядке уменьшения их окислительной способности:
1) I2, Br2, Cl2, F2
2) F2, Cl2, Br2, I2
3) F2, I2, Cl2, Br2
4) F2, Cl2, I2, Br2
2.3. Число нейтронов в составе нуклида 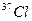 больше числа протонов в составе нуклида
больше числа протонов в составе нуклида  на:
на:
1) 1
2) 2
3) 3
4) 5.
2.4. Какое максимальное число ковалентных связей по обменному механизму может образовать атом брома:
1) 1
2) 2
3) 5
4) 7.
2.5. Хлор образуется при:
1) действии концентрированной серной кислоты на поваренную соль;
2) действии соляной кислоты на бертолетову соль;
3) термическом разложении бертолетовой соли;
4) действии щелочи на хлороформ.
2.6. Укажите формулу вещества, с которым реагирует бром:
1) KCl
2) CCl4
3) HCl
4) CH3COOH.
2.7. Какое простое вещество не реагирует со щелочью по схеме
Х2 + ОН- ® Х- + ХО3-:
1) фтор
2) хлор
3) бром
4) иод.
2.8. Укажите, какие степени окисления не может проявлять бром в соединениях:
1) -2
2) +1
3) +5
4) +7
2.9. Наиболее сильными кислотными свойствами обладает соединение:
1) HF
2) HI
3) H2S
4) H3P.
2.10. Хлор не может взаимодействовать с веществами:
1) H2O
2) NaCl
3) NaOH
4) P
Элементы VI А группы (халькогены).
3.1. Степень окисления атомов серы последовательно растет в ряду веществ:
1) S8, H2S, BaS
2) SCl4, H2SO3, S
3) FeS; FeS2;SO2
4) NH4HSO3, K2SO4, NaHSO3
3.2. Окислительно-восстановительной является реакция оксида серы с веществом, формула которого:
1) NaOH (р-р)
2) PbO2
3) CaO
4) Na2SO3 (р-р)
3.3. Пропускание избытка сернистого газа через раствор щелочи приводит к образованию соли состава:
1) K2CO3
2) KHSO3
3) NaHS
4) NaHSO4
3.4. Окислительная способность кислот непрерывно растет в ряду (концентрации веществ в разбавленных растворах равны):
1) H2S, H2Te, H2Se
2) H2S, H2SO4 (разб), H2SO4 (конц.)
|
|
|
3) H2SO3, H2S, H2SO4 (разб.)
4)HCLO4, H2SO4 (конц), H3PO4(конц)
3.5. Укажите все вещества, с которыми может реагировать концентрированная серная кислота: а)кислые соли; б) неметаллы; в) соли сильных кислот (нитраты и др.); г) амфотерные оксиды:
1) а,б,в,г
2) а,б,г
3) а,в,г
4) б,в,г
3.6. Каким способом получают кислород в промышленности (указанные реакции термического разложения):
1) KClO3 →
2) KMnO4 →
3) NaNO3 →
4) сжижение воздуха при низких температурах и его дальнейшей фракционной перегонки
3.7. В результате какой реакции происходит накопление кислорода в природе:
1) 6CO2 + 6 H2O → C6H12O6+6O2
2) 2H2O → 2H2O + O2 (электролиз)
3) 2O3 = 3O2
4) 2Cu(NO3)2 = 2CuO+4NO2+O2
3.8. При сгорании 1 моль CH4 выделяется 802 кДж энергии. Какое количество энергии выделяется при сгорании 32 г метана:
1) 802 кДж
2) 401 кДж
3) 1604 кДж
4) 160,4 кДж
3.9. Методом электронного баланса расставьте коэффициенты в схеме окислительно-восстановительной реакции H2S + KMnO4 + H2SO4 = K2SO4 + MnSO4+ S+ H2O. Укажите коэффициент перед серой:
1) 2
2) 4
3) 3
4) 5
3.10. Какой из перечисленных газов нельзя высушить с помощью серной кислоты:
1) O2
2) NH3
3) N2
4) Ar
|
|
|


