 |
Растворы электролитов. Электролитическая диссоциация
|
|
|
|
РАСТВОРЫ
Основные понятия. Классификация растворов
|
Раствор содержит растворитель и одно или несколько растворенных веществ.Обычно растворителем считают компонент, находящийся в том же агрегатном состоянии, что и образующийся раствор. Если компоненты, образующие раствор, находятся в одном агрегатном состоянии, растворителем в этом случае чаще считают количественно преобладающий компонент. Если вода является одним из веществ раствора, ее, как правило, считают растворителем.
Основные способы выражения концентрации растворов
Концентрация – величина, определяющая количественный состав раствора. Основными способами выражения концентрации растворов являются следующие.
|
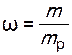 ;
;  ,
,
где m – масса растворенного вещества, г;
m р – масса раствора, г;
rр – плотность раствора, г/мл;
Vp – объем раствора, мл.
Массовая доля – величина безразмерная.
|
 ;
;
 .
.
Размерность С – %.
|
 ,
,
где n – количество растворенного вещества, моль;
V p– объем раствора, л.
Размерность молярной концентрации (молярности) – моль/л, сокращенное обозначение М. Например, растворы, содержащие доли моля растворенного вещества в литре раствора, обозначают и называют соответственно:
|
|
|
0,1 М – децимолярный раствор,
0,01 М – сантимолярный раствор.
С учетом того, что
 ,
,
выражение для молярной концентрации
 ,
,
где  – масса растворенного вещества, г;
– масса растворенного вещества, г;
М – молярная масса растворенного вещества, г/моль;
V p – объем раствора, л.
При растворении данного вещества (T = const) концентрация раствора увеличивается до достижения определенного значения, которое не изменяется с течением времени. Это признак наступления фазового равновесия
растворяемое вещество  раствор.
раствор.
|
В частности, все твердые вещества обладают способностью в той или иной мере растворяться в различных жидкостях, в том числе, в воде. Различие в растворимости твердых веществ может быть очень большим. Например, растворимость AgNO3 в воде при 250С равна 15,1 моль/л, а HgS – всего 1.10-21 моль/л.
|
Растворы электролитов. Электролитическая диссоциация
|
Причиной электропроводности растворов электролитов является наличие в них заряженных частиц – ионов.
|
Количественно процесс диссоциации характеризуют степенью диссоциации.
|
|
|
|
Выражают степень диссоциации в долях единицы или в процентах. Степень диссоциации зависит от природы растворенного вещества и растворителя, от температуры и концентрации раствора.
Наибольшей степенью диссоциации характеризуются вещества с ионной связью. Например, при растворении хлорида натрия в воде под действием полярных молекул растворителя ослабляются связи в кристаллическом веществе, и частицы переходят в раствор с образованием гидратированных ионов:
NaCl + nH2O = Na+(H2O)x + Cl-(H2O)n-x.
Чем полярнее молекулы растворителя, тем выше степень диссоциации растворенного вещества. Так вещество с ионной связью, NaCl, не диссоциирует в неполярном растворителе – бензоле и проявляет свойства сильного электролита в воде.
Диссоциация большинства соединений – эндотермический процесс, поэтому с повышением температуры согласно принципу Ле Шателье степень диссоциации, как правило, увеличивается.
Степень диссоциации также возрастает при разбавлении раствора. Например, при понижении концентрации раствора уксусной кислоты от 0,1М до 0,001М степень диссоциации увеличивается от 1,4 до 12,4%.
|
|
|


