 |
Реакционная способность элементов IV группы
|
|
|
|
IV группа периодической системы
ЭЛЕМЕНТЫ
На рис. 15.4 показано расположение в периодической таблице пяти элементов IV группы. Подобно элементам III группы, они принадлежат, к числу p-элементов. Атомы всех элементов IV группы имеют однотипную электронную конфигурацию внешней оболочки:. В табл. 15.4 указаны конкретная электронная конфигурация атомов и некоторые свойства элементов IV группы. Эти и другие физические и химические свойства элементов IV группы связаны с их строением, а именно: углерод (в форме алмаза), кремний и германий имеют каркасную кристаллическую алмазоподобную структуру (см. разд. 3.2); олово и свинец имеют металлическую структуру (гранецентрированную кубическую, см. также разд. 3.2).

Рис. 15.4. Положение элементов IV группы в периодической системе.
При перемещении вниз по группе происходит возрастание атомного радиуса элементов и ослабление связи между атомами. Из-за последовательно усиливающейся делокализации электронов внешних атомных оболочек в этом же направлении пррисходит и возрастание электропроводности элементов IV группы. Их свойства
Таблица 15.4. Электронные конфигурации и физические свойства элементов IV группы
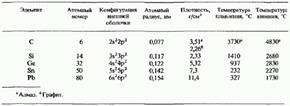
постепенно изменяются от неметаллических к металлическим: углерод - неметаллический элемент и в форме алмаза является изолятором (диэлектриком); кремний и германий - полупроводники; олово и свинец - металлы и хорошие проводники.
Из-за возрастания размера атомов при переходе от элементов верхней части группы к элементам ее нижней части происходит последовательное ослабление связи между атомами и, соответственно этому, уменьшение температуры плавления и температуры кипения, а также твердости элементов.
|
|
|
Аллотропия
Кремний, германий и свинец существуют каждый лишь в одной структурной форме. Однако углерод и оловосуществуют в нескольких структурных формах. Различные структурные формы одного элемента называются аллотропами (см. разд. 3.2).
Углерод имеет два аллотропа: алмаз и графит. Их структура описана в разд. 3.2. Аллотропия углерода - пример монотропии, для которой характерны следующие особенности: 1) аллотропы могут существовать в определенном интервале температур и давлений (например, как алмаз, так и графит существуют при комнатной температуре и атмосферном давлении); 2) не существует температуры перехода, при которой один аллотроп превращается в другой; 3) один аллотроп более устойчив, чем другой. Например, графит обладает большей устойчивостью, чем алмаз. Менее устойчивые формы называются метастабилъными. Следовательно, алмаз представляет собой метастабильный аллотроп (или монотроп) углерода.
Углерод может еще существовать в других формах, к которым относятся древесный уголь, кокс и газовая сажа. Все они являются неочищенными формами углерода. Иногда их называют аморфными формами, а раньше считали, что они представляют собой третью аллотропную форму углерода. Термин аморфный означает бесформенный. В настоящее время установлено, что «аморфный» углерод-это не что иное, как микрокристаллический графит.
Олово существует в трех аллотропных формах. Они называются: серое олово (а-олово), белое олово (Р-олово) и ромбическое олово (у-олово). Аллотропия такого типа, как у олова, называется энантиотропией. Она характеризуется следующими особенностями: 1) превращение одного аллотропа в другой происходит при определенной температуре, называемой температурой перехода; например
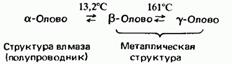
Структура влмаза Металлическая (полупроводник) структура 2) каждый аллотроп устойчив только в определенном интервале температур.
|
|
|
Реакционная способность элементов IV группы
Реакционная способность элементов IV группы в целом возрастает при перемещении к нижней части группы, от углерода к свинцу. В электрохимическом ряду напряжений только олово и свинец расположены выше водорода (см. разд. 10.3). Свинец очень медленно реагирует с разбавленными кислотами, высвобождая водород. Реакция между оловом и разбавленными кислотами протекает с умеренной скоростью.
Углерод окисляется орячими концентрированными кислотами, например концентрированнойазотной кислотой и концентрированной серной кислотой:

Кремний не реагирует ни с какими кислотами, кроме плавиковой (фтороводородной) кислоты.
Все элементы IV группы, кроме углерода, реагируют со щелочами. Например, кремний реагирует с разбавленным раствором гидроксида натрия, образуя силикат натрия:

Олово и свинец реагируют с горячим концентрированным раствором гидроксида натрия, образуя и соответственно.
Все элементы IV группы, за исключением свинца, при нагревании реагируют с кислородом, образуя диоксиды. Например
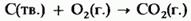
Свинец соединяется с кислородом, образуя оксид РЬО.
Углерод восстанавливает водяной пар (см. разд. 12.1) и оксиды многих металлов (см. разд. 5.3).
СОЕДИНЕНИЯ
Мы уже отмечали, что при перемещении к нижней части IV группы усиливается металлический характер элементов. Углерод и кремний образуют ковалентные соединения с молекулярной или каркасной (макромолекулярной) структурой. Лишь свинец и олово образуют соединения ионного типа. Эти закономерности находят отражение и в значениях первой энергии ионизации, электроотрицательности и стандартного окислительно-восстановительного потенциала рассматриваемых элементов (табл. 15.5).
Степени окисления
Все элементы IV группы образуют соединения, в которых они обладают степенью окисления Устойчивость соединений, в которых элементы IV группы имеют эту Степень окисления, уменьшается при перемещении к нижней части группы. Например, углерод и кремний образуют каждый по четыре прочные ковалентные связи. Образование этих связей происходит вследствие промотирования (возбуждения) одного s-электрона на р-орбиталь и появления в результате этого четырех -гибридных орбиталей.
|
|
|
Таблица 15.5. Свойства элементов IV группы

Таблица 15.6. Устойчивость различных состояний окисления у элементов IV группы

Все элементы IV группы, кроме кремния, образуют также соединения, в которых они имеют степень окисления Возникновение этого состояния окисления объясняется так называемым эффектом инертной пары. В больших атомах, таких, как атомы олова и свинца, d- и f-электроны не столь хорошо экранируют внешние электроны, как это делают s- и р-электроны внутренних оболочек. В результате внешние -электроны, находящиеся на сферических орбиталях, гораздо сильнее притягиваются к ядру, чем внешние р-электроны. Таким образом, пара внешних -электронов как бы втягивается во внутреннюю электронную оболочку и поэтому становится «инертной».Устойчивость соединений, в которых элементы IV группы имеют степень окисления возрастает при перемещении к нижней части группы (табл. 15.6). Так, моноксид углерода СО легко окисляется с образованием более устойчивого диоксида углерода. Соединения, содержащие кремний со степенью окисления встречаются редко. Кремний в своих соединениях обнаруживает оба состояния окисления, но соединения, куда он входит со степенью окисления более устойчивы. Например, устойчивее, чем Соединения оловасо степенью окисления несколько более устойчивы, чем со степенью окисления Поэтому ион имеет тенденцию к окислению с образованием иона и может выступать в роли восстановителя. Например

Соединения свинца со степенью окисления устойчивее, чем со степенью окисления. Поэтому имеет тенденцию к восстановлению до и, следовательно, может выступать в роли окислителя. Например, оксид окисляет соляную кислоту с образованием хлора:

Особые свойства углерода
Углерод выделяется среди других элементов своей способностью образовывать соединения, в которых его атомы связаны друг с другом в длинные цепи или кольца. Такое свойство называется катенацией. Именно это свойство позволяет углероду образовывать миллионы соединений, изучению которых посвящена целая областьхимии - органическая химия.
|
|
|
Способность углерода к катенации объясняется тем, что прочность связи сопоставима с прочностью связей Для сравнения укажем, что связь намного прочнее связи Si—Si, как это видно по энтальпиям связей, которые указаны в табл. 15.7.
Как было уже указано в разд. 2.1, углерод обладает также уникальной способностью к гибридизации. Орбитали, на которых находятся четыре его валентных электрона, могут подвергаться гибридизации, образуя:
четыре -орбитали, имеющие тетраэдрическую ориентацию; с помощью этих орбиталей углерод образует простые ковалентные связи;
Таблица 15.7. Энтальпии связей, образуемых углеродом и кремнием

три -орбитали, ориентированные в одной плоскости; с помощью этих орбиталей углерод образует двойные связи;
две sр-орбитали, имеющие линейную ориентацию; с помощью этих орбиталей углерод может образовывать тройные связи.
Оксиды
Элементы IV группы образуют моноксиды, в которых они имеют степень окисления 4- 2, и диоксиды, в которых они имеют степень окисления Способность образовывать устойчивые диоксиды уменьшается при перемещении к нижней части группы, а способность образовывать устойчивые моноксиды, наоборот, возрастает.
Диоксид углерода Диоксид углерода в нормальных условиях находится в газообразном состоянии в форме линейных молекул (см. гл. 2). Это бесцветный газ, не имеет запаха, тяжелее воздуха. Твердый имеет гранецентрированную кубическую структуру, подобную структуре иода (см. разд. 3.2). Он сублимирует (возгоняется) при температуре -78 °С.
Диоксид углерода представляет собой один из обычных продуктов сгорания углерода или любых углеродсодержащих соединений в условиях обильного поступления кислорода или воздуха. В лабораторных условиях его чаще всего получают, добавляя разбавленную соляную кислоту к карбонату кальция в форме мраморных крошек, что приводит к реакции

Диоксид углерода обладает кислотными свойствами, и при растворении этого газа в воде образуется угольнаякислота; при этом устанавливается целый ряд равновесий:

Аналитическая проба на диоксид углерода заключается в пропускании газа через разбавленный раствор гидроксида кальция (известковая вода). Диоксид углерода вызывает образование в этом растворе нерастворимого карбоната кальция, в результате чего раствор становится мутным:

Однако при добавлении избыточного количества мутный раствор снова становится прозрачным из-за превращения нерастворимого карбоната кальция в растворимый гидрокарбонат кальция:

Диоксид углерода образует также карбонаты и (будучи в избытке) гидрокарбонаты при его пропускании через растворы других щелочей, например гидроксида натрия.
|
|
|
При нагревании с металлами, относящимися к верхней части электрохимического ряда напряжений, диоксид углерода восстанавливается до углерода. Например

Оксид. Оксид называется также кремнеземом или диоксидом кремния. Он имеет каркасную кристаллическую структуру и существует в трех аллотропных формах: кварц, тридимит и кристобалит (см. разд. 3.2).
Это кислотный оксид; он реагирует со щелочами, образуя силикаты:

Диоксиды других элементов IV группы. Диоксиды всех остальных элементов IV группы, т. е. представляют собой ионные соединения и обнаруживают амфотерные свойства. Оксид при нагревании теряет кислород:

Моноксид углерода СО. Моноксид углерода - бесцветный и не имеющий запаха газ с сильным отравляющим действием (угарный газ). Его электронное строение можно представить себе как результат наложения трех резонансных форм (резонансным гибридом которых он является):

Моноксид углерода плохо растворим в воде и образует нейтральный раствор. При и давлении 10 атм он реагирует с раствором гидроксида натрия, образуя метаноат натрия (формиат натрия):
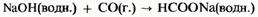
Моноксид углерода легко окисляется; на воздухе он горит голубым пламенем, образуя диоксид углерода:

Он является хорошим восстановителем и благодаря этому используется для промышленного получения железа иникеля, например

Моноксид углерода реагирует с некоторыми элементами, образуя летучие карбонильные соединения. Например

Тетракарбонилникель (0)
Такие карбонильные соединения относятся к ковалентному типу и имеют тетраэдрическую структуру.
Другие оксиды. Оксид и оксид -неустойчивые соединения. Оксид при нагревании диспропорционирует (см. разд. 10.2):

Степень окисления
Оксид и оксид обладают амфотерными свойствами. Тетраоксид трисвинца, или так называемый (свинцовый) сурик, представляет собой пример смешанного оксида: это смешанный оксид Он имеет эмпирическую формулу и состоит из двух частей РЬО и одной части При нагревании он высвобождает кислород:

Хлориды
Тетрахлориды элементов IV группы являются ковалентными соединениями и существуют в форме простых молекул с тетраэдрической структурой (рис. 15.5). При комнатной температуре все они представляют собой летучие жидкости. Их термическая

Рис. 15.5. Тетраэдрическая структура молекулы тетрахлорида кремния.
устойчивость уменьшается при перемещении к элементам нижней части группы. Это особенно видно на примере хлорида который при температуре кипения разлагается со взрывом.
Тетрахлорометан можно получить, пропуская газообразный хлор через жидкий сероуглерод:

Он получается также в результате реакции хлора с метаном в присутствии ультрафиолетового света (см. разд. 18.1):

Тетрахлориды кремния, германия и олова можно получать, нагревая эти элементы с хлором. Например

При нагревании свинца в атмосфере хлора образуется хлорид Хлорид получают в результате реакции оксида с избытком концентрированной соляной кислоты в присутствии хлора при 0°С. Суммарное уравнение протекающих при этом реакций имеет вид

Все тетрахлориды, кроме гидролизуются водой. Например

Легкость гидролиза уменьшается в направлении от кремния к олову в соответствии с возрастанием металлического характера элементов.
Термическая неустойчивость хлорида приводит к тому, что в присутствии воды он быстро гидролизуется. При этом образуются оксид и некоторое количество хлорида
Среди элементов IV группы только германий, олово и свинец образуют устойчивые дихлориды. Все они представляют собой твердые вещества со свойствами ионных соединений.
Для получения хлорида можно использовать реакцию олова с концентрированной соляной кислотой:

Хлорид свинца нерастворим в воде. Это позволяет получать его ионным осаждением, например добавляя разбавленную соляную кислоту или раствор хлорида натрия к водному раствору нитрата

Золотисто-желтый иодид свинца получают аналогичным способом (см. разд. 4.2).
Гидриды
Способность элементов IV группы к катенации (см. выше) заметно уменьшается при перемещении к нижней части группы. Это хорошо демонстрируется способностью обсуждаемых элементов образовывать гидриды.Углерод образует множество бинарных гидридов. Часть из них представляет собой соединения с длинными молекулярными цепями, а другие являются циклическими соединениями. В совокупности они называются углеводородами. Эти соединения подробно обсуждаются в гл. 18.
Кремний образует ряд бинарных гидридов, называемых силанами. Синтезированы силаны, содержащие до 11 атомов кремния. Бинарные гидриды германия называются германами. Известно всего три таких соединения.Олово образует только два бинарных гидрида, Свинец образует лишь один бинарный гидрид.
Для химии элементов IV группы наиболее важное значение имеют тетрагидриды. Все они - ковалентные соединения, существующие в форме простых молекул тетраэдрической структуры. Они характеризуются низкими температурами плавления и кипения и при комнатной температуре существуют вгазообразном состоянии. Термическая устойчивость тетрагидридов уменьшается при перемещении к нижней части группы. Гидрид настолько неустойчив, что его не удается получить при комнатной температуре.
Карбонаты
Карбонат-ион подобно другим оксоанионам имеет такое электронное строение, что его можно представить как резонансный гибрид, полученный наложением нескольких предельных форм (см. разд. 2.1 и рис. 2.10).
Карбонат аммония и карбонаты всех металлов I группы, кроме карбоната лития, растворимы в воде. Все остальные карбонаты нерастворимы в воде.
При нагревании карбонаты разлагаются с образованием соответствующего оксида и диоксида углерода. Наибольшей термической устойчивостью обладают карбонаты элементов II группы. Например, карбонатыкальция и бария разлагаются при температурах порядка 1000°С.
Все карбонаты реагируют с разбавленными минеральными кислотами, образуя соответствующую соль, диоксид углерода и воду. Например

Если образующаяся при этом соль нерастворима в воде, она покрывает карбонат слоем, который замедляет дальнейшее протекание реакции.
|
|
|


