 |
Тепловые свойства твердых тел
|
|
|
|
Тепловое движение в кристаллах из-за сильного взаимодействия ограничивается только колебаниями частиц около узлов кристаллической решетки. Амплитуда этих колебаний обычно не превращает 10-11 м, т.е. составляет всего 5-7% периода решетки вдоль соответствующего направления. Характер этих колебаний весьма непрост, так как определяется силами взаимодействия колеблющейся частицы со всеми своими соседями.
Рост температуры означает увеличение энергии движения частиц. Это в свою очередь, означает увеличение амплитуды колебаний частиц и объясняет расширение кристаллических твердых тел при нагревании.
l t= l 0(1 + αt0),
где l t и l 0 – линейные размеры тела при температурах t0 и 00С, α – коэффици-ент линейного расширения. Для твёрдых тел α имеет порядок 10-5 – 10-6 К-1. В результате линейного расширения увеличивается и объём тела:
Vt = V0(1 + βt0),
здесь β – коэффициент объёмного расширения. β = 3α в случае изотропного расширения. Монокристаллические тела, будучи анизотропными, имеют три разных значения α.
Каждая частица, совершающая колебания, имеет три степени свободы колебательного движения. Учитывая, что, кроме кинетической, частицы обладают еще и потенциальной энергией, на одну степень свободы частиц твёрдых тел следует приписать энергию ε = кТ. Теперь для внутренней энергии моля будем иметь:
Uμ = 3NAkT = 3RT,
а для молярной теплоемкости:
Сμ,V =3R.
Т.е. молярная теплоемкость химически простых кристаллических тел одинакова и не зависит от температуры. Это закон Дюлонга-Пти.
Как показал эксперимент, этот закон достаточно хорошо выполняется, начиная с комнатных температур. Объяснения отклонениям от закона Дюлонга-Пти при низких температурах были даны Эйнштейном и Дебаем в квантовой теории теплоемкости. Было показано, что энергия, которая приходится на одну степень свободы не является постоянной величиной, а зависит от температуры и частоты колебаний.
|
|
|
РЕАЛЬНЫЕ КРИСТАЛЛЫ. ДЕФФЕКТЫ В КРИСТАЛАХ
Реальные кристаллы обладают рядом нарушений идеальной структуры, которые называются дефектами кристаллов:
а) точечные дефекты –
· дефекты Шотки (незанятые частицами узлы);
· дефекты Френкеля (смещение частиц из узлов в междуузлия);
· примеси (внедренные чужеродные атомы);
б) линейные – краевые и винтовые дислокации. Это локальные нерегулярно
сти в расположения частиц
· из-за недостроенности отдельных атомных плоскостей
· или из-за нарушений в последовательности их застройки;
в) плоскостные – границы между кристаллитами, ряды линейных дислокаций.
Фазовые переходы. ДиаграммА состояния. Тройная точка.
Фазой называется термодинамическое равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Переход вещества из одной фазы в другую – фазовый переход - всегда связан с качественными изменениями свойств тела. Примером фазовых переходов могут служить изменения агрегатного состояния. Но понятие «фазовый переход» шире, т.к. оно включает и переход вещества из одной модификации в другую при сохранении агрегатного состояния (полиморфизм), например, превращение алмаза в графит.
Различают два вида фазовых переходов:
Фазовый переход 1 рода – сопровождается поглощением или выделением теплоты, изменением объема и протекает при постоянной температуре. Примеры: плавление, кристаллизация, испарение, сублимация (возгонка) и др.
Фазовые переходы 2 рода – протекают без выделения или поглощения тепла, с сохранением величины объема, но скачкообразным изменением теплоемкости. Примеры: переход ферромагнитных минералов при определенных значениях давления и температуры в парамагнитное состояние (железо, никель); переход некоторых металлов и сплавов при температуре близкой к 00К в сверхпроводящее состояние (ρ = 0 Ом∙м) и др.
|
|
|
Для химически однородного вещества понятие фазы совпадает с понятием агрегатное состояние. Рассмотрим для такой системы фазовые превращения, используя для наглядности диаграмму состояния. На ней в координатах р и Т задается зависимость между температурами фазовых переходов и давлением. Эти зависимости в виде кривых испарения (ОИ), плавления (ОП) и сублимации (ОС) и образуют диаграмму состояния.
Точка О пересечения кривых определяет условия (значения Т и р), при которых все три агрегатные состояния вещества находятся в термодинамическом равновесии.
 По этой причине она называется тройной точкой. Например, тройная точка воды является одной из реперных точек температурной шкалы Цельсия (00С). Как следует из уравнения Клапейрона – Клаузиуса характер зависимости Т = f(р) для перехода твердое тело – жидкость (кривые ОП) может быть разным: Если вещество при переходе в жидкую фазу увеличивает объем (вода, висмут, германий, чугун …), то ход этой зависимости представлен на рис. 2а. Для веществ, уменьшающих объём при переходе в жидкую фазу, зависимость имеет вид показанный на рис. 2б.
По этой причине она называется тройной точкой. Например, тройная точка воды является одной из реперных точек температурной шкалы Цельсия (00С). Как следует из уравнения Клапейрона – Клаузиуса характер зависимости Т = f(р) для перехода твердое тело – жидкость (кривые ОП) может быть разным: Если вещество при переходе в жидкую фазу увеличивает объем (вода, висмут, германий, чугун …), то ход этой зависимости представлен на рис. 2а. Для веществ, уменьшающих объём при переходе в жидкую фазу, зависимость имеет вид показанный на рис. 2б.
Кривая испарения заканчивается критической точкой – К. Как видно из диаграммы, существует возможность непрерывного перехода жидкости в газообразную фазу без пересечения кривой испарения, т.е. без присущих такому переходу фазовых превращений.
При давлении меньшим, чем ртр.тчк., вещество может существовать только в двух фазах: твердой и газообразной. Причем, при температурах, меньших Ттр.тчк., возможен переход из твердого состояния в газ минуя жидкую фазу. Такой процесс называется сублимацией или возгонкой. Удельная теплота сублимации
τсуб = λпл + rисп
ТВЕРДЫЕ ТЕЛА.
Твердое тело, агрегатное состояние вещества, для которого характерно наличие значительных сил межмолекулярного взаимодействия, стабильность формы и объема. Тепловое движение частиц твердого тела представляет собой небольшие по амплитуде колебания около положений равновесия. Различают кристаллическое и аморфное строение твердых тел.
|
|
|
Характерной особенностью микроструктуры кристаллов является пространственная периодичность их внутренних электрических полей и повторяемость в расположении кристаллообразующих частиц – атомов, ионов и молекул (дальний порядок). Частицы чередуются в определенном порядке вдоль прямых линий, которые называются узловыми. В любом плоском сечении кристалла две пересекающихся системы таких линий образуют совокупность совершенно одинаковых параллелограммов, которые плотно, без зазоров покрывают плоскость сечения. В пространстве пересечение трех некомпланарных систем таких линий образует пространственную сетку, которая разбивает кристалл на совокупность совершенно одинаковых параллелепипедов. Точки пересечения линий, образующих кристаллическую решетку называются узлами. Расстояния между узлами вдоль какого-то направления называется трансляциями или периодами решетки. Параллелепипед, построенный на трех некомпланарных трансляциях, называется элементарной ячейкой или параллелепипедом повторяемости решетки. Важнейшим геометрическим свойством кристаллических решеток является симметрия в расположении частиц по отношению к определенным направлениям и плоскостям. По этой причине, хотя и существует несколько способов выбора элементарной ячейки, для данной кристаллической структуры, выбирают ее так, чтобы она соответствовала симметрии решетки.
Существует два признака, по которым классифицируются кристаллы: а) кристаллографический – по геометрии кристаллической решетки и б) физический – по характеру взаимодействия частиц, расположенных в узлах кристаллической решетки и их природе.
Геометрия кристаллических решеток и их элементарных ячеек определяется количеством элементов симметрии, использованных при построении данной решетки. Число возможных видов симметрии ограничено. Русский кристаллограф Е.С. Федоров (1853 – 1919) показал, что существует всего 230 возможных комбинаций элементов симметрии, которые путем параллельного переноса, отражения и вращения обеспечивают плотную, т.е. без зазоров и щелей упаковку элементарных ячеек в пространстве. Браве показал, что существует всего 14 типов решеток, которые различаются по виду переносной симметрии. Различают примитивные (простые), базоцентрированные, обьемноцентрированные и гранецентрированные решетки Браве. По форме ячейки в зависимости от углов между ее гранями α, β и γ и соотношением между длиной ребер а, б и с эти 14 типов решеток образуют семь кристаллических систем (сингоний): кубическую, гексогональную, тетрагональную, тригональную или ромбоэдрическую, ромбическую, моноклинную и тригональную.
|
|
|
По характеру взаимодействия частиц, расположенных в узлах кристаллической решетки и их природе кристаллы делятся на четыре типа: ионные, атомные, металлические и молекулярные
Ионные – в узлах кристаллической решетки располагаются ионы противоположных знаков; взаимодействие обусловлено электростатическими силами притяжения (ионная или гетерополярная связь).
Атомные – в узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах гомеополярными, или ковалентными связями.
Металлические – в узлах кристаллической решетки располагаются положительные ионы металла; свободные электроны образуют, так называемый, электронный газ, который и обеспечивает связь ионов.
Молекулярные – в узлах кристаллической решетки располагаются нейтральные молекулы, силы взаимодействия между которыми обусловлены незначительным смещением электронного облака атома (поляризационные или ван-дер-ваальсовские силы).
Кристаллические тела можно разделить на две группы: монокристаллы и поликристаллы. Для монокристаллов наблюдается единая кристаллическая решетка в объеме всего тела. И хотя внешняя форма монокристаллов одного вида может быть разной, углы между соответствующими гранями будут всегда одинаковыми. Характерной особенностью монокристаллов является анизотропия механических, тепловых, электрических, оптических и др. свойств.
Монокристаллы нередко встречаются в естественном состоянии в природе. Например, большинство минералов – хрусталь, изумруды, рубины. В настоящее время в производственных целях многие монокристаллы выращивают искусственно из растворов и расплавов - рубины, германий, кремний, арсенид галия.
Один и тот же химический элемент может образовать несколько, отличающихся по геометрии, кристаллических структур. Это явление получило название - полиморфизма. Например, углерод – графит и алмаз; лед пять модификаций и др.
|
|
|
Правильная внешняя огранка и анизотропия свойств, как правило, не проявляются для кристаллических тел. Это объясняется тем, что кристаллические твердые тела обычно состоят из множества беспорядочно ориентированных мелких кристалликов. Такие твердые тела называются поликристаллическими. Связано это с механизмом кристаллизации: при достижении необходимых для этого процесса условий, очаги кристаллизации одновременно возникают во множестве мест исходной фазы. Зародившиеся кристаллы расположены и ориентированы друг по отношению к другу совершенно хаотически. По этой причине по окончании процесса мы получаем твердое тело в виде конгломерата сросшихся мелких кристалликов – кристаллитов.
ДЕФФЕКТЫ В КРИСТАЛАХ.
Реальные кристаллы обладают рядом нарушений идеальной структуры, которые называются дефектами кристаллов:
а) точечные дефекты
- дефекты Шотки (незанятые частицами узлы);
- дефекты Френкеля (смещение частиц из узлов в междуузлия);
- примеси (внедренные чужеродные атомы);
б) линейные – дислокации краевые и винтовые локальные нарушения в регулярности расположения частиц, из-за недостроенности отдельных атомных плоскостей, или в последовательности их застройки;
в) плоскостные – границы между зеркалами, ряды линейных дислокаций.
АМОРФНЫЕ ТВЕРДЫЕ ТЕЛА.
Аморфные твердые тела по многим своим свойствам и главным образом по микроструктуре следует рассматривать как сильно переохлажденные жидкости с очень высоким коэффициентом вязкости. С энергетической точки зрения различие между кристаллическими и аморфными твердыми телами хорошо прослеживаются в процессе отвердевания и плавления. Кристаллические тела имеют точку плавления – температуру, когда вещество устойчиво существует в двух фазах – твердой и жидкой (рис1). Переход молекулы твердого тела в жидкость означает, что она приобретает дополнительно три степени свободы поступательного движения. Т.о. единица массы вещества при Тпл. в жидкой фазе имеет большую внутреннюю энергию, чем такая же масса в твердой фазе. Кроме того, меняется расстояние между частицами. Поэтому в целом количество теплоты необходимое для превращения единицы массы кристалла в жидкость будет:
λ = (Uж-Uk) + P (Vж-Vk),
где λ – удельная теплота плавления (кристаллизации), (Uж-Uk) – разность внутренних энергий жидкой и кристаллической фаз, Р – внешнее давление, (Vж-Vk) – разность удельных объемов. Согласно уравнению Клайперона - Клаузиуса температура плавления зависит от давления:
 .
.
Видно, что если (Vж-Vk)> 0, то 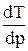 > 0, т.е. с ростом давления температура плавления повышается. Если же объем вещества при плавлении уменьшается (Vж-Vk)< 0 (вода, висмут), то рост давления приводит к понижению Тпл.
> 0, т.е. с ростом давления температура плавления повышается. Если же объем вещества при плавлении уменьшается (Vж-Vk)< 0 (вода, висмут), то рост давления приводит к понижению Тпл.
У аморфных тел теплота плавления отсутствует. Нагревание приводит к постепенному увеличению скорости теплового движения и уменьшению вязкости. На графике процесса имеется точка перегиба, которую условно называют температурой размягчения.
Фазовые переходы. Диаграммы состояния. Тройная точка.
Фазой называется термодинамическое равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Переход вещества из одной фазы в другую – фазовый переход - всегда связан с качественными изменениями свойств тела. Примером фазовых переходов могут служить изменения агрегатного состояния. Но понятие «фазовый переход» шире, т.к. оно включает и переход вещества из одной модификации в другую при сохранении агрегатного состояния (полиморфизм). Пример, превращение алмаза в графит. Различают два вида фазовых переходов.
Фазовый переход 1 рода – сопровождается поглощением или выделением теплоты, изменением объема и протекает при постоянной температуре. Примеры: плавление, кристаллизация, испарение, сублимация (возгонка) и др.
Фазовые переходы 2 рода – протекают без выделения или поглощения тепла, с сохранением величины объема, но скачкообразным изменением теплоемкости. Примеры: переход ферромагнитных минералов при определенных значениях давления и температуры в парамагнитное состояние (железо, никель); переход некоторых металлов и сплавов при температуре близкой к 00К в сверхпроводящее состояние (ρ = 0 Ом∙м) и др.
Для химически однородного вещества понятие фазы совпадает с понятием агрегатное состояние. Рассмотрим для такой системы фазовые превращения, используя для наглядности диаграмму состояния (рис2). На ней в координатах Р и Т задается зависимость между температурами фазовых переходов и давлением. Эти зависимости в виде кривых испарения (ОИ), плавления (ОП) и сублимации (ОС) и образуют диаграмму состояния.
Точка О пересечения кривых определяет условия (Т и Р), когда все три агрегатных состояний вещества находятся в термодинамическом равновесии. По этой причине она называется тройной точкой. Например, тройная точка воды является одной из реперных точек (00С) температурной шкалы Цельсия. Как следует из уравнения Клайперона – Клаузиуса характер зависимости Т = f(Р) перехода твердое тело – жидкость для веществ, которые при переходе в жидкую фазу увеличивают объем (вода, германий, чугун), рис.2а, и веществ, для которых характерно уменьшение объема, рис. 2б - разный.
Кривая испарения заканчивается критической точкой - К. Как видно из диаграммы, существует возможность непрерывного перехода жидкости в газообразную фазу без пересечения кривой испарения, т.е. без присущих такому переходу фазовых превращений.
При давлении меньшим, Р – тройной точки, вещество может существовать только в двух фазах: твердой и газообразной. Причем, при температурах, меньших Ттр.тчк., возможен переход из твердого состояния в газ минуя жидкую фазу. Такой процесс называется сублимацией или возгонкой. Удельная теплота сублимации
τсуб = λпл + rисп
|
|
|


