 |
Лекция 71. Строение атома. Опыты Резерфорда. Модель атома водорода по Бору
|
|
|
|
Цель занятия: раскрыть пути выхода из кризиса классической физики.
Тип занятия: занятие изучения нового материала.
ПЛАН ЗАНЯТИЯ
| Контроль знаний | 1. Что представляла собой модель атома, предложенная Томсоном? 2. Опишите модель атома, предложенную Резерфордом. Почему ее назвали планетарной моделью? 3. Почему планетарная модель атома не могла объяснить устойчивость атомов? |
| Изучение нового материала | 1. Квантовые постулаты Бора. 2. Последствия постулатов Бора. 3. Спектральный анализ. 4. Атомные спектры и теория Бора |
| Закрепление изученного материала | 1. Решение задач. 2. Контрольные вопросы |
ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
1. Квантовые постулаты Бора
Датский физик Нильс Бор дополнил планетарную модель атома положениями, которые должны были устранить недостатки этой модели.
Размышляя над проблемой устойчивости планетарного атома, Бор убедился, что «это вопросы просто невозможно решить с помощью уже известных правил». Бор понял, что не все законы классической физики пригодны к явлениям атомных масштабов и что для описания свойств атомов нужна новая - квантовая - теория.
После нескольких месяцев работы Бор в 1913 году опубликовал свою квантовую теорию атома. Основу этой теории составляют постулаты Бора.
1). Атомная система может находиться только в определенных (стационарных или квантовых) состояниях, каждому из которых соответствует определенная энергия Еn. В стационарном состоянии атом не излучает.
2). Во время перехода атома из одного стационарного состояния в другое происходит испускание или поглощение кванта электромагнитной энергии. Энергия кванта равна разности энергий стационарных состояний:
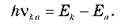
Из второго постулата Бора следует, что атом может излучать и поглощать свет только с определенными значениями частот, которые определяются формулой 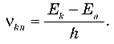 Это так называемое «правило частот».
Это так называемое «правило частот».
|
|
|
Если электрон перескакивает на другую орбиту, на которой его энергия меньше, то куда девается избыток энергии? Ведь исчезнуть, превратиться в ничто энергия не может. «Ищите ее вне атомом!» - заявляет Бор. Она выделяется из атома в виде кванта. Того самого кванта световой энергии, что был введен Планком, а электрон, что излучив, движется по орбите, теперь уже другой, и снова не излучает.
Атом может не только излучать, но и поглощать фотоны: во время поглощения фотона электрон в атоме переходит со стационарной орбиты с меньшей энергией на орбиту с большей энергией. Когда электроны в атоме находятся на стационарных орбитах с наименьшей возможной энергией, говорят, что атом находится в основном состоянии. Все другие состояния атома называются возбужденными.
2. Последствия постулатов Бора
Постулаты Бора показали, что источником света является возбужденный атом. Свет генерируется при переходе атома из одного возбужденного состояния в другое. Частота генерируемого света пропорциональна ΔЕ, свет излучается и поглощается в виде квантов.
Сходство атомов одного и того же химического элемента объясняется в теории Бора тем, что во всех атомах данного элемента стационарные орбиты электронов те же.
Наибольший успех теория Бора имела применительно атома Водорода, для которого оказалось возможным построить количественную теорию. Однако уже для следующего по сложности атома - атома Гелия - добиться количественной согласованности с опытом не удалось, не говоря уже о более сложные атомы.
Дальнейшее развитие физики доказал, что трудности теории Бора были связаны с ее внутренней противоречивостью, потому что в ней сочетались законы классической физики и противоречащие им постулаты Бора.
|
|
|
3. Спектральный анализ
Явление дисперсии используют в науке и технике для определения состава вещества, т.е. проведение спектрального анализа. В основе этого метода лежит изучение света, излучаемого или поглощаемого веществом.
Ø Спектральным анализом называют метод изучения химического состава вещества, основанный на исследовании его спектров.
Для получения и исследования спектров используют спектральные аппараты. Наиболее простые спектральные приборы - призма и дифракционная решетка. Более точные - спектроскоп и спектрограф.

Дифракционная решетка
Спектроскопом называется прибор, с помощью которого визуально исследуется спектральный состав света, которое выпускает определенный источник.
Если регистрация спектра происходит на фотопластинке, то прибор называется спектрографом.
Раскаленные твердые и жидкие тела и газы (из-за большого давления) излучают свет, разложение которого дает сплошной спектр, в котором спектральные цвета непрерывно переходят один в один.
Сплошные спектры одинаковы для разных веществ, и поэтому их нельзя использовать для определения состава вещества.
Возбужденные атомы разреженных газов или паров излучают свет, разложение которого дает линейчатый спектр, состоящий из отдельных цветных линий. Каждый химический элемент имеет характерный для него линейчатый спектр. Атомы таких веществ не взаимодействуют друг с другом и излучают свет только определенных длин волн.
Изолированные атомы определенного химического элемента излучают строго определенные длины волн. Это позволяет за спектральными линиями судить о химическом составе источника света.
Ø Излучения изолированных атомов определенного химического элемента имеет строго определенные длины волн.
Положение спектральных линий линейчатого спектра не зависит от того, какова причина свечения газа:
· нагрев;
· пропускание электрического тока и др.
Рассмотрены спектры называют спектрами излучения. Но существуют еще спектры поглощения. Чтобы их наблюдать, необходимо пропустить свет с непрерывным спектром через холодный атомарный газ. Наличие темных линий в спектре свидетельствует, что соответствующие световые волны газ поглощает.
|
|
|
Ø Атомы поглощают излучение только тех длин волн, которые они могут выпускать по данной температуры.
Во время спектрального анализа спектральные линии сравнивают со спектральными линиями определенного химического элемента. Если соответствующие длины волн совпадают, это свидетельствует о наличии данного химического элемента в исследуемом объекте. По интенсивности спектральных линий можно определить количество данного химического элемента.
Преимущество спектрального анализа - скорость, высокая чувствительность (можно обнаружить примеси массой 10-10 г), возможность провести анализ объекта на большом расстоянии от него.
С помощью спектральных методов были открыты новые химические элементы (гелий, рубидий, цезий и др.), осуществлен химический анализ Солнца и далеких звезд. Спектральный анализ применяют в металлургии, машиностроении, криминалистике, для контроля состава полупроводниковых материалов.
4. Атомные спектры и теория Бора

Нильс Бор
Постулаты Бора объясняют происхождение линейчатых спектров и их закономерности. Физики до появления теории Бора ломали голову, пытаясь расшифровать сложные спектры. Когда же Бор доказал, что «спектр - это биография атомов, точнее атомных электронов», ученым стало легче. Комбинируя различные орбиты электронов в атоме, можно вычислить все наблюдаемые линии в спектре.
Сочетая положения классической физики со своими постулатами, Нильс Бор сумел вычислить энергетические уровни электрона в атоме водорода и, используя соотношение  частоты излучения света атомом Водорода, то есть найти вид линейчатого спектра излучения.
частоты излучения света атомом Водорода, то есть найти вид линейчатого спектра излучения.
Исчисленный Бором спектр атома Водорода совпал с ранее измеряемым спектром, причем не только в области видимого света, но и в области ультрафиолетового и инфракрасного излучения.
Решение задач
1. На рисунке показаны энергетические уровни атома. Стрелками обозначены переходы между уровнями. Во время переходов которых происходит поглощение излучения? За которого перехода выпускается излучения максимальной длины волны? За которого перехода выпускается излучения максимальной частоты?
|
|
|
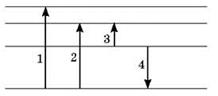
2. Во время облучения атом Водорода перешел с первого энергетического состояния в третье. Возвращаясь в исходное состояние, он сначала перешел из третьего состояния во второе, а затем из второго в первый. Сравните энергии фотонов, которые поглощает и излучает атом.
Контрольные вопросы
Первый уровень
1. Почему планетарная модель атома не согласуется с законами классической физики?
2. При каком условии атом не излучает энергию?
3. В каком состоянии энергия электрона меньше: в основном или возбужденном?
4. Какой спектр излучает раскаленный кусок железа? расплавленное железо? пары железа?
Второй уровень
1. В чем заключается противоречие между постулатами Бора и законами классической физики?
2. Что определяется по линиям поглощения в солнечном спектре: состав атмосферы Солнца или же состав его глубинных слоев?
3. Чем определяют частоту излучения атома по теории Бора?
4. Какими способами можно перевести атом в возбужденное состояние?
Домашнее задание
1. Учебник.: § 27 (п. 2); § 28 (п. 1);
2. Сборник.:
Уровень1 № 16.2; 16.3; 16.4; 16.6.
Уровень2 № 16.9; 16.10; 16.11; 16.12.
Уровень3 № 16.16, 16.17; 16.18.
Список использованной литературы
1. Физика. 11 класс: учеб. для общеобразоват. учреждений: базовый и профил. уровни / Г. Я. Мякишев, Б. Б. Буховцев, Н. Н. Сотский; под ред. В. И. Николаева, Н. А. Парфентьевой. — 19-е изд. — М.: Просвещение, 2010. — 366 с.: ил.
2. Марон А.Е., Марон Е.А. «Сборник задачорник качественных задач по физике 11 кл, М.: Просвещение,2006
3. Л.А. Кирик, Л.Э.Генденштейн, Ю.И.Дик. Методические материалы для преподавателя 10 класс,М.:Илекса, 2005.-304с:, 2005
4. Л.Э.Генденштейн, Ю.И.Дик. Физика 11 класс.-М.: Мнемозина,2010
|
|
|


