 |
Классификация электролитов
|
|
|
|
| Класс соединений | Сильные электролиты | Слабые электролиты |
| Кислоты | НCl, H2SO4, HNO3, HClO4 | H2CO3, CH3COOH, H2SO3, H3PO4, HCN, H2S, HNO2 |
| Основания | KOH, NaOH, Ca(OH)2 | Fe(OH)3, Zn(OH)2, NH4OH, Al(OH)3 |
| Соли | K2SO4, NaNO3, LiCl | BaSO4, CaCO3, AgCl |
В растворах электролитов реакции протекают между ионами и идут до конца в случае образования труднорастворимых, малодиссоциированных и легколетучих веществ.
Пример записи уравнения ионной реакции:
FeSO4 + 2NaOH = Fe(OH)2¯ + Na2SO4; (87)
Fe2+ + 2OH- = Fe(OH)2¯.
Многие химические реакции протекают при определенной реакции сре-ды – определенном соотношении ионов H+ и OH-.
Применение закона действия масс к процессу диссоциации воды приводит к понятию об ионном произведении воды:
H2О = H+ + OH-;K =  . (88)
. (88)
Поскольку в разбавленных растворах концентрация нейтральных молекул воды Н2О практически постоянна, то величина
KB = K×[H2О] = [H+]×[OH-] (89)
при данной температуре тоже является постоянной. Эта величина получила название ионного произведения воды. Из опытных данных известно, что KB= 1,8×10-16, а концентрация молекул воды в одном литре определяется по формуле:
H2О =  H2О =
H2О = 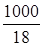 = 55,56. (90)
= 55,56. (90)
Следовательно,
KB= 1,8×10-16×55,56 = 1×10-14; (91)
[H+] = [OH-] 1×10-14 = 1×10-7. (92)
Прологарифмировав уравнение (1.87) и обозначив отрицательные лога-рифмы концентраций ионов Н+ и ОН- через рН и рОН, получим:
pH = -lg[H+]; pOH = -lg[OH-]; (93)
pH + pOH = 14.
Шкала рН имеет вид:
 Кислая Нейтральная Щелочная
Кислая Нейтральная Щелочная
1 2 3 4 5 6 7 8 9 10 11 12 13 14
В нейтральной среде [Н+] = [ОН-], следовательно,
pH = pOH = 7. (94)
В кислой среде, где концентрация Н+ больше, pH < 7, в щелочной, где концентрация Н+ меньше, pH > 7.
Гидролиз - взаимодействие катионов и анионов солей с водой. Результатом гидролиза является образование слабых (малодиссоциирующих) электролитов - оснований или кислот.
|
|
|
Рассмотрим основные случаи гидролиза солей.
1) Соли, образованные сильным основанием и сильной кислотой (например, NaCl, KNO3, Na2SO4). Реакция раствора соли практически нейтральная, гидролизу такие соли не подвергаются.
В водном растворе хорошо растворимый сильный электролит диссоциирован нацело: NaCl = Na+ + Cl-, взаимодействие ионов Na+ и Cl- с молекулами воды к образованию слабого электролита не приводит, реакция гидролиза отсутствует.
2) Соли, образованные сильным основанием и слабой кислотой (например, Na2CO3, K2S, CH3, COONa). Реакция раствора соли щелочная, в результате реакции гидролиза образуется слабый электролит - кислота:
Na2CO3 = 2Na+ + CO32-; (95)
CO32- + H2O ⇄ HCO3- + OH-; (96)
HCO3- + H2O ® H2CO3 + OH-; (97)
CH3COONa = CH3COO- + Na+; (98)
CH3COO- + H2O ⇄ CH3COOH + OH-. (99)
3) Соли, образованные слабым основанием и сильной кислотой (например, FeSO4, CuCl2, AlCl3). Реакция раствора соли кислая, в результате реакции гидролиза образуется слабый электролит – основание:
CuCl2 = Cu2+ + 2Cl–; (100)
Cu2+ + H2O ⇄ CuOH+ + H+; (101)
CuOH+ + H2O ⇄ Cu(OH)2 + H+; (102)
FeSO4 = F2+ + SO42–; (103)
Fe2+ + H2O ⇄ FeOH+ + H+; (104)
FeOH+ +H2O ⇄ Fe(OH)2 + H+. (105)
Напомним, что реакции гидролиза обратимы, поскольку вода – один из самых слабых электролитов, и равновесие реакции гидролиза сильно смещено влево, до конца гидролиз практически никогда не идет.
4) Соли, образованные слабым основанием и слабой кислотой (например, CH3COONH4, Al2S3, Cr2S3). Реакция гидролиза идет практически до конца, она является в данном случае необратимой. Образующиеся при гидролизе катиона ионы Н+ связываются образующимися при гидролизе аниона ионами ОН–:
CH3COONH4 = CH3COO– + NH4+; (106)
CH3COO– + H2O ⇄ CH3COOH + OH–; (107)
NH4+ + H2O ⇄ NH4OH + H+; (108)
H+ + OH– ® H2O; (109)
 2Al3+ + 6H2O ⇄ Al(OH)3 + 6H+,
2Al3+ + 6H2O ⇄ Al(OH)3 + 6H+,
 Al2S3 + H2O ® (110)
Al2S3 + H2O ® (110)
3S2– + 6H2O ⇄ 3H2S + 6OH–;
H+ + OH– ® H2O.
Соль Al 2S3, таким образом, водой разлагается полностью:
Al 2S3 + 6H2O = 2 Al(OH)3¯ + 3H2S. (111)
1.4.6. Кристаллогидраты
В водных растворах ионы солей всегда гидратированы. Часто эти соединения – гидраты – столь прочны, что не разрушаются при выделении вещества из раствора. Кристаллические гидраты и называются кристаллогидратами. Их кристаллические решетки образованы гидратированными ионами, например:
|
|
|
CuSO4 × 5H2O — [Cu(H2O)4]2+ и [SO4(H2O)]2–; (112)
CoCl2 × 6H2O — [Co(H2O)6]2+ и 2Cl–. (113)
Ионы солей можно рассматривать как комплексные соединения. Попадая в почву, соли загрязняют ее, повышая кислотность или щелочность почвы в результате гидролиза. Влажная соль вызывает коррозию металлических емкостей.
1.4.7. Особенности транспортировки солей
Перевозят соли в бумажных, полиэтиленовых мешках или специальных контейнерах в крытых вагонах.
Неукоснительного соблюдения правил перевозок опасных химических грузов требует транспортировка солей, способных разлагаться с выделением кислорода или воспламеняться в смеси с другими веществами. К таким солям относятся хлораты, перхлораты, нитраты, перманганаты и др.:
4KClO3 ® KCl + 3KClO4; (114)
KClO4 ® KCl + 2O2; (115)
2Pb(NO3)2 ® 2PbO + 4NO2 + O2; (116)
5KMnO4 ® K2MnO4 + K3MnO4 + MnO2 + 3O2. (117)
Так, хлорат калия KClO3 (бертолетова соль) в смеси с легко окисляющимися веществами (фосфором, серой, углем и некоторыми органическими веществами) взрывается от удара. Взрывоопасные смеси образуют хлораты, перманганаты с концентрированной серной кислотой.
Комплектуя железнодорожные составы, нельзя рядом размещать цистерны и вагоны с веществами, которые энергично взаимодействуют друг с другом.
Свои особенности имеет перевозка нитрата аммония (аммиачная селитра). Эта соль широко используется в технике и прежде всего при производстве взрывчатых веществ, в сельском хозяйстве – в качестве удобрения.
При нагревании до 300°С или при детонации нитрат аммония подвержен взрывному распаду:
2NН4NO3 ® 2N2 + O2 + 4H2O+ 238 (кДж). (118)
Хранить и перевозить навалом эту соль нельзя. Хранят ее в бумажных пятислойных мешках с тремя битумными слоями. В помещении не должно быть других удобрений, горючесмазочных материалов, органических веществ. Перевозят аммиачную, калиевую, натриевую селитры в специальных вагонах, оборудованных резинокордными контейнерами.
Хлорид и сульфат аммония хранят в бумажных мешках.
В битумированных или полиэтиленовых мешках хранят удобрения – фосфоритную муку Са3(РО4)2, простой суперфосфат [Cа(Н2РО4)2 + СаSO4], двойной суперфосфат Са(Н2РО4)2, сложные (смешанные) удобрения (аммофос, нитрофоску и др.).
|
|
|
При транспортировке фосфорных удобрений возможно образование пылегазовых смесей – фтористых соединений SiF4, H2SiF6 (побочных продуктов, образующихся при получении удобрений). Поэтому вагоны после выгрузки двойного суперфосфата, фосфоритной муки моют горячей водой под давлением. Однако нельзя мыть вагоны, в которых перевозился простой суперфосфат. Содержащийся в нем сульфат кальция (гипс) при обработке водой затвердевает,
поэтому от простого суперфосфата вагоны отмывают 2–3%-ным раствором кальцинированной соды Na2CO3. Сливные воды сильно загрязняют почву, поэтому их следует сливать в очистительные емкости.
Специализированные вагоны для перевозки минеральных удобрений имеют кузова из низколегированной стали, которая под действием солей подвергается коррозии, в качестве защиты от коррозии можно использовать полимерные покрытия, стеклоткани. Коррозионную стойкость узлов и деталей вагонов можно повысить, используя пластмассы, легированные стали, коррозионно-стойкие легкие сплавы.
2. КОНТРОЛЬНЫЕ ВОПРОСЫ
1) Какие химические соединения называются оксидами? Назовите известный кислотный оксид из взаимодействующих с водой. Какие из нижеприведенных оксидов попарно могут между собой взаимодействовать: CaO, CO2, SiO2, Al2O3, BaO?.Напишите уравнения реакций и укажите условия их проведения.
2) Какие химические соединения называются: а) кислотами; б) основаниями (гидроксидами)? Какие основания называются щелочами? Приведите примеры кислот и оснований, назовите их.
3) Можно при добавлении кислоты к раствору соли получить гидроксид металла?
4) Чем определяется сила кислот и оснований?
5) Какова может быть основность кислоты?
6) К какому классу соединений относится вода?
7) Что является условием возможности получения кислот из солей действием других кислот?
8) Зачем вводится кислород в реакции получения азотной кислоты из диоксида азота?
|
|
|
9) Напишите уравнения электролитической диссоциации соляной, серной, азотной, ортофосфорной, угольной, уксусной кислот, а также гидроксидов натрия, калия, кальция, аммония. Укажите сильные и слабые электролиты.
10) Что такое амфолиты? Приведите примеры, напишите уравнение электролитической диссоциации амфолитов.
11) Как меняется степень диссоциации электролита при разбавлении?
12) Какие соединения называются солями? Назовите соли соляной, азотной, серной, ортофосфорной, угольной, уксусной кислот по международной номенклатуре.
13). Напишите уравнение электролитической диссоциации аммонийных солей азотной и серной кислот.
14) Что называется гидролизом солей? Как меняется реакция среды при растворении в воде различных солей? Какой величиной выражается кислотность среды?
15) Валентность и степень окисления. Приведите примеры типичных окислителей и восстановителей. Правила составления уравнений окислительно-восстановительных реакций.
16) Почему соляную кислоту нельзя перевозить в обычных стальных цистернах?
17) Почему концентрированную азотную кислоту можно хранить в железной таре, а разбавленную – нет?
18) Чем объяснить, что концентрированная азотная кислота имеет буроватый оттенок?
19) В чем заключается пассивация металлов концентрированными азотной и серной кислотами? Напишите уравнение реакции между концентрированной азотной кислотой и алюминием.
20) Можно ли ставить рядом цистерны с концентрированной азотной кислотой и органическими растворителями – скипидаром, ацетоном и др.? Что может произойти в случае столкновения цистерн при аварии и разлива этих веществ?
21) С чем связано обугливание органических веществ – углеводов концентрированной серной кислотой?
22) Можно ли разлившуюся концентрированную серную кислоту нейтрализовать водой?
23) Почему концентрированные и разбавленные азотная, серная кислоты перевозятся в разных цистернах?
24) В каких цистернах перевозят 100%-ную серную кислоту?
25) В каких цистернах перевозят кислотный меланж, олеум?
26) Какие соли относятся к опасным химическим грузам? Почему эти соли считают опасным при транспортировке?
27) Как хранят и перевозят аммиачную селитру? Укажите окислитель и восстановитель в окислительно-восстановительной реакции разложения аммиачной селитры при нагревании или детонации?
28) Фосфорные удобрения. От каких фосфорных удобрений вагоны отмывают: а) горячей водой под давлением; б) раствором кальцинированной соды? Почему сливные воды рекомендуется пропускать через очистные емкости?
29) Почему газообразный аммиак перевозят в сжиженном состоянии?
|
|
|
30) Какие трафареты ставят на цистернах с соляной кислотой, сжиженным аммиаком?
3. ТЕСТ ДЛЯ САМОКОНТРОЛЯ
В предлагаемом тестовом задании предусмотрены готовые ответы, среди которых правильным является только один. Работая с тестом, надо отметить (например, обвести кружком) номера правильных ответов, после чего сверить ответы с эталоном, который приведен в конце методических указаний. Для ответа на каждый вопрос надо постараться затрачивать не более одной минуты.
1. Только кислотные оксиды содержатся в ряду:
1) K2O, Mn2O7, SO2; 3) CuO, SO3, CrO3;
2) P2O5, SO3, CO2; 4) CO2, CaO, SiO2.
2. Только амфотерные гидроксиды находятся в ряду:
1) Zn(OH)2, Al(OH)3; 3) RbOH, Ca(OH)2;
2) Cu(OH)2, Fe(OH)3; 4) Mn(OH)2, Cr(OH)2.
3. Гидроксид натрия будет взаимодействовать с веществом:
1) СаО; 3) СO2;
2) СаCO3; 4) Na2O.
4. В химическое взаимодействие могут вступать следующие пары веществ:
1) SO3 и HCl; 3) P2O5 и SO2;
2) CO2 и NO2; 4) CaH2 и H2O.
5. Нейтрализовать раствор серной кислоты можно с помощью:
1) СH3OH; 3) NaH2PO4;
2) Mg(OH)2; 4) FeCl3.
6. Во всех приведенных ниже схемах химических реакций:
HCl +... ® NaCl + H2O;
... + CO2 ® Na2CO3 + H2O;
Al(OH)3 +... ® Na[Al(OH)4];
... + FeCl3 ® Fe(OH)3 + NaCl
пропущено одно и то же вещество:
1) Na2O; 3) NaOH;
2) Na2CO3; 4) H2SO4.
7. Одновременно основной и кислотный оксиды образуются при термическом разложении соли:
1) СuCO3; 3) NH4NO3;
2) NaNO3; 4) KClO3.
8. Среди приведенных ниже схем реакцией нейтрализации является:
1) NaCl + H2SO4 ®...; 3) FeS + H2SO4 ®...;
2) Cu + HNO3 ®...; 4) NaOH + H2SO4 ®....
9. В полученном из раствора карбоната натрия кристаллогидрате содержится 19,8 % натрия. Формула полученного кристаллогидрата:
1) Na2CO3; 3) Na2CO3×7H2O;
2) Na2CO3×H2O; 4) Na2CO3×10H2O.
10. Раствор какого вещества в воде имеет щелочную среду:
1) газа хлороводорода; 3) ацетата аммония;
2) сульфата аммония; 4) соды?
Ответы
| Номер вопроса | ||||||||||
| Правильный ответ |
Библиографический список
1. Глинка Н. Л. Общая химия. Л.: Химия, 1990.
2. Курс общей химии / Под ред. Н. В. Коровина/ Высшая школа. М., 1990.
3. Специальные цистерны и вагоны для перевозки химических и нефтяных продуктов / НИИТЭХим. М., 1968.
4. Прохоров А. А., Суворов С. В., Боярчук И. Ф. Профилактические меры при перевозке опасных грузов на железнодорожном транспорте: М.: Транспорт, 1985.
КРУГЛОВА Лидия Николаевна,
ЗЫРЯНОВА Ирина Михайловна
КЛАССИФИКАЦИЯ И СВОЙСТВА
НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ,
ОСОБЕННОСТИ ИХ ПЕРЕВОЗКИ
|
|
|


