 |
Формулы, необходимые для решения задач по теме
|
|
|
|
Занятия № 1, 2
Тема: “Растворы и их роль в жизнедеятельности”
Занятие № 1
Теория
1. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обусловливающие её уникальную роль как единственного биорастворителя.
2. Коллигативные свойства разбавленных растворов неэлектролитов. Закон Рауля: формулировки, расчетные формулы.
3. Следствие из закона Рауля: понижение температуры замерзания растворов, повышение температуры кипения растворов.
4. Осмос. Осмотическое давление. Закон Вант-Гоффа для растворов неэлектролитов.
Задачи
1. В 300 г водного раствора содержится 50 г сахарозы.
Рассчитайте молярную долю растворителя.
Определите давление насыщенного пара растворителя над раствором при температуре 20 оС, если давление пара растворителя над растворителем в тех же условиях равно 18,11 мм рт. ст.
2. Раствор, содержащий 43 г неэлектролита в 500 мл воды, замерзает при t = -1,36 оС.
Рассчитайте относительную молекулярную массу растворенного вещества. Кк (Н2О) = 1,86 кг×К/моль.
3. Осмотическое давление раствора объемом 0,5 л, в котором содержится 40 г гемоглобина, при 4 оС равно 2634 Па.
Установите молярную массу гемоглобина.
Формулы, необходимые для решения задач по теме
“Растворы неэлектролитов”
1. Закон Рауля для неэлектролитов: Относительное понижение давления насыщенного пара растворителя над раствором нелетучего вещества равно его молярной доле:
 , где
, где
Ро – давление насыщенного пара растворителя над растворителем,
Р – давление насыщенного пара растворителя над раствором,
N – молярная доля растворенного вещества,
n – количество растворенного вещества,
|
|
|
nо – количество вещества растворителя.
После преобразования получим:
 ,
,
2. Следствие из закона Рауля: Повышение температуры кипения растворов неэлектролитов:


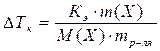
 , где
, где
в(Х) – моляльность вещества Х в растворе, моль/кг;
Х – формула растворённого вещества;
Кэ – эбулиометрическая константа растворителя.
Кэ (Н2О) = 0,52 кг∙К∙моль-1.
3. Следствие из закона Рауля: Понижение температуры замерзания растворов неэлектролитов прямо пропорционально моляльности вещества в растворе:



 , где
, где
в(Х) – моляльность вещества Х в растворе, моль/кг;
Х – формула растворённого вещества;
Кк – криоскопическая константа растворителя.
Кк (Н2О) = 1,86 кг∙К∙моль-1.
4. Закон Вант-Гоффа: Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации растворенного вещества:


 , где
, где
π – осмотическое давление,
С(Х) – молярная концентрация вещества Х,
Х – формула растворённого вещества;
R –универсальная газовая постоянная (R = 8,31 л·кПа·моль-1·К-1),
Т – абсолютная температура (Т = t + 273).
Лабораторные работы
1. Рост искусственной клетки Траубе.
2. Осмос и осмотическое давление.
Занятие № 2
Теория
1. Осмотические свойства растворов электролитов. Изотонический коэффициент.
2. Гипо-, гипер-, изотонические растворы. Понятие об изоосмии (электролитном гомеостазе). Осмоляльность и осмолярность биологических жидкостей.
3. Роль осмоса в биологических сиcтемах. Плазмолиз и цитолиз. Зависимость степени гемолиза эритроцитов от концентрации раствора NaCl.
4. Закон разведения Оствальда для бинарных электролитов (формулировка, математическое выражение).
5. Активность. Коэффициент активности ионов. Ионная сила раствора: определение зависимость от различных факторов.
Задачи
1. Температура кипения водного раствора NaOH 102,65 оС. Кажущаяся степень ионизации электролита равняется 70%.
|
|
|
Установите, какую массу NaOH растворили в 100 г воды.
2. Осмотическое давление 0,04 М раствора электролита при t = 0 оС составляет 2,178·.105 Па. Экспериментальное значение a = 0,7.
Определите число ионов, на которые диссоциирует электролит.
Формулы, необходимые для решения задач по теме
“Растворы электролитов”
1. Следствие из закона Рауля для растворов электролитов:


 , где
, где
i – изотонический коэффициент.
i = 1+α(n-1), где
α – кажущаяся степень диссоциации,
n – число ионов, на которое диссоциирует электролит.
Лабораторные работы
1. Приготовление раствора меньшей концентрации из раствора большей концентрации.
Литература:
1. Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд; Под. ред. Ю.А. Ершова. – 10-е изд., перераб. и доп. – М.: Изд-во Юрайт, 2014. – 560 с. – Серия: Бакалавр. Базовый курс.
2. Ершов Ю.А., Попков А.А., Берлянд А.С. Общая химия. Биофизическая химия. Химия биогенных элементов. Под. ред. Ю.А. Ершова – М.: Высшая школа, 1993. С. 42-51.
3. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М.: Высшая школа, 1975, ч. 1, гл. II.
4. Ленский А.С. Введение в бионеорганическую и биофизическую химию. М.: Высшая школа, 1989, с.93-102, 112-125
|
|
|


