 |
Графики термической обработки: простой и сложной
|
|
|
|
Процесс кристаллизации.
При переходе металла из жидкого состояния в твердое образуются кристаллы. Такой процесс называют кристаллизацией.

Процесс кристаллизации металла можно рассматривать по кривым охлаждения, которые обычно получают опытным путем. Например, для чистого металла, охлаждаемого очень медленно, кривая охлаждения показывает, что, если металл находится в жидком состоянии, температура понижается почти равномерно. Если металл охладить до температуры плавления Т пл (точка а на кривой), то начинается кристаллизация ипадение температуры прекращается, несмотря на непрерывную отдачу тепла окружающей атмосфере. Получаемый горизонтальный участок на кривой охлаждения показывает, что в металле происходит процесс образования кристаллов с выделением тепла, называемый теплотой кристаллизации. Кристаллизация протекает от точки а до точки б, где она заканчивается и металл затвердевает. Дальнейшее падение температуры на кривой указывает на охлаждение затвердевшего слитка (рис. А).
В металлических сплавах кривая охлаждения имеет несколько иной вид. Охладившись до температуры плавления ТПл, сплав еще некоторое время остается жидким. Кристаллизация сплава начинается при температуре переохлаждения Тп, лежащей ниже теоретической температуры плавления. Разность между теоретической и фактической температурами кристаллизации называют степенью переохлаждения. Она зависит от природы сплава, его чистоты и скорости охлаждения. Чем больше скорость охлаждения сплава, тем больше степень переохлаждения. Петля на кривой охлаждения показывает, что кристаллизация сопровождается выделением тепла, которое повышает температуру сплава до температуры плавления, поддерживая ее до полного затвердевания металла. (рис.Б)
|
|
|
Слитки, получаемые в изложницах, отличаются неравномерностью структуры и состава по сечению. Строение слитка спокойной стали, разрезанного вдоль вертикальной оси, показано на рис. 10.8. [c.186]
Схема строения слитка спокойной стали приведена на рис. 1.16. Структура слитка состоит из трех зон наружной мелкозернистой зоны /, зоны столбчатых кристаллов II и зоны равноосных кристаллов 3
6.Фазы в меаллических сплавах
В сплавах компоненты могут вступать во взаимодействие с образованием различных фаз. Различают следующие фазы металлических сплавов:
—жидкие растворы;
—твердые растворы;
—химические соединения.
Раствором называется твердая или жидкая гомогенная (однородная) система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах.
Жидкие растворы. Большинство металлов растворяются друг в друге в жидком состоянии неограниченно (в любых соотношениях). При этом образуется однородный жидкий раствор, в котором атомы растворимого металла равномерно распределены среди атомов металла-растворителя.
Твердые растворы. В твердом растворе металл-растворитель сохраняет свою кристаллическую решетку, а растворимый элемент (металл или неметалл) распределяется в ней в виде отдельных атомов. Твердые растворы бывают двух типов:
· твердые растворы замещения — и
· твердые растворы внедрения.
В твердых растворах замещения (рис., а) часть атомов кристаллической решетки металла-растворителя замещена атомами другого компонента. Атомы растворенного компонента могут замещать атомы растворителя в любых узлах решетки.
В твердых растворах внедрения (рис. 5, б) атомы растворенного компонента внедряются в межатомное пространство кристаллической решетки компонента-растворителя. При этом атомы располагаются в таких пустотах, где для них имеется больше свободного пространства.
|
|
|
Таким образом, твердый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу.
При образовании твердого раствора кристаллическая решетка всегда искажается, так как атомы растворителя и растворенного компонента различны. Искажение кристаллической решетки обусловливает изменение свойств сплавов по сравнению со свойствами исходных компонентов. Образование твердых растворов в сплавах приводит к увеличению их электрического сопротивления, снижает пластичность и вязкость.
Химические соединения. Химические соединения и родственные им фазы постоянного состава в металлических сплавах многообразны. Они имеют характерные особенности, отличающие их от твердых растворов:
—их кристаллическая решетка отличается от кристаллических решеток компонентов, образующих
соединение;
—соотношение элементов в них кратно целым числам;
—их свойства отличны от свойств образующих элементов;
—они плавятся при постоянной температуре;
—их образование сопровождается значительным
тепловым эффектом.
7.Диаграммы состояния сплавов для случая нерастворимости компонентов в твердом состоянии 1 типа
Диаграмма состояния сплавов системы представлена на рисунке 1.

Рисунок 1 – Диаграмма состояний сплавов с эвтектикой
В этих сплавах компоненты в твердом состоянии нерастворимы друг в друге и химически не взаимодействуют.
Однофазные области диаграммы:
1) жидкость L – выше линии ликвидус DCE;
2) фаза А – линия 0FD;
3) фаза В – линия 100-G-E.
Характерной точкой диаграммы является тройная точка С, ей соответствует эвтектический сплав, содержащий С'% В. Эвтектика в этих сплавах состоит из кристаллов А и В, ее область на диаграмме – линия СС'. Линия FCG– линия эвтектического превращения: Lэвт–>эвт(А+В). Эта же линия – солидус. Кристаллизация сплавов этой системы начинается на линии DCE с выделения твердых кристаллов компонента, избыточного по отношению к эвтектическому составу, и заканчивается на линии FCG – эвтектическим превращением.
Структурные составляющие сплавов (и их области на диаграмме):
|
|
|
1) кристаллы А – линия 0FD;
2) кристаллы В – линия 100-G-E;
3) кристаллы эвтектики (эвт(А+В)) – линия СС'.
8.Диаграмма состояния сплавов для случая неограниченной растворимости компонентов в твердом состоянии
Диаграмма состояний сплавов с неограниченной растворимостью компонентов представлена на рисунке 1.

Рисунок 1 – Диаграмма состояний сплавов с неограниченной
растворимостью компонентов
В этих сплавах компоненты в твердом состоянии неограниченно растворяются друг в друге; при этом образуется взаимный твердый раствор α. В данном случае чистые компоненты А и В не являются самостоятельными фазами системы, – они представляют собой предельные частные случаи твердого раствора α.
Однофазные области на диаграмме:
1) жидкость L – выше линии ликвидус CDE;
2) твердый раствор α – ниже линии солидус CFE.
Кристаллизация сплавов этого типа начинается на линии СDE и заканчивается на линии CFE постепенным переходом жидкого раствора L в твердые кристаллы α. Структуры всех сплавов этого типа при комнатной температура подобны: однородные кристаллы твердого раствора α, являющиеся единственной структурной составляющей в сплавах этого типа.
9.Диаграмма состояния сплавов для случая ограниченной растворимости компонентов в твердом состоянии
В этих сплавах в твердом состоянии компоненты растворяются друг в друге с образованием твердых растворов α (В в А) и β (А в В), между которыми образуется эвтектика эвт(α+β).
Однофазные области на диаграмме:
1) жидкость L – выше линии ликвидус DCE;
2) тв. раствор α – область 0DFK0;
3) тв. раствор β – область NGE-100-N.

Рисунок 1 – Диаграмма состояний сплавов с ограниченной растворимостью
Линии верхней части диаграммы – образование кристаллов твердых растворов α и β.
Однако, в отличии от предыдущей диаграммы, предельное содержание компонента B в α ограничено: оно не может быть более М% В (в точке F). Аналогично, предельное содержание А в β не может быть более (100-N)% A (в точке G). То есть, в данном случае при растворении компонентов друг в друге образуются так называемые ограниченные твердые растворы α и β.
|
|
|
В общем случае, при снижении температуры после достижения предела растворимости (т.е. ниже уровня FCG) предельное содержание растворенного компонента в твердом растворе может изменяться. Эта зависимость предела растворимости от температуры твердого раствора α показана линией FK, а для β – линией GN. Видно, что с уменьшением температуры возможное содержание В в α уменьшается (от М% В до К% В при 0ºС). Поэтому, при охлаждении сплавов, содержащих от К % В до М % В, ниже линии FK из них будет выделяться оказавшаяся избыточная часть компонента В в виде кристаллов вторичного βII (доказывается правилом отрезков), и в области KFMK сплавы будут иметь фазовый состав α+βII.
В частном случае, показанном линией GN, предел растворимости А в β не зависит от температуры и кристаллы твердого раствора β, образовавшиеся на линии GE, будут охлаждаться до комнатной температуры без каких-либо внутренних изменений.
В средней части диаграммы сплавы кристаллизуются с образованием эвтектики на линии FCG. Эвтектика содержит С/% В и кристаллизуется по реакции: Lэвт–>эвт(α+β). В доэвтектических сплавах этой области в конечной структуре сплава будут присутствовать кроме эвтектики кристаллы (α+βII), а в заэвтектических – кристаллы β.
Структурные составляющие сплавов:
1) кристаллы α – область 0DFK0;
2) кристаллы β – область NGE-100-N;
3) кристаллы эвтектики эвт(α+β) – линия СС/.
10.Диаграмма состояния сплавов для случая образования компонентами химического соединения
В этих сплавах компоненты химически реагируют друг с другом, образуя химическое соединение АmВn. Это соединение представляет собой новую фазу и имеет соответствующую однородную область на диаграмме состояния (линия PF на рисунке). Линия хим. соединения проходит через точку Р, соответствующую содержанию компонента В в АmВn и разделяет общую диаграмму А-В на две независимые части: А-АmВn и АmВn–В, каждую из которых можно рассматривать отдельно и для каждой из них соединение АmВn играет роль «компонента».
В каждой части тип диаграммы состояния может быть, вообще говоря, любым. В частности, на рисунке в качестве примера приведены системы А-АmВn и АmВn-В эвтектического типа.

Рисунок 1 – Диаграмма состояний сплавов с химическим соединением
Однофазные области этой диаграммы:
1) жидкость L – выше линии ликвидус ECFDG;
2) компонент А – линия 0HE;
3) компонент B – линия 100-N-G;
4) химическое соединение АmВn – линия РF.
Структурные составляющие сплавов этой системы и их области на диаграмме:
|
|
|
1) кристаллы А – линия ОNЕ;
2) кристаллы B – линия 100–N–G;
3) кристаллы АmВn – линия РF;
4) эвтектика эвт1(А+ АmВn) – линия СС/;
5) эвтектика эвт2(АmВn+В) – линия DD/.
Типичным сплавом, соответствующим данной диаграмме, является сплав магний-германий, диаграмма состояния которого представлена на рисунке 1. В этих сплавах компоненты химически реагируют друг с другом, образуя химическое соединение Mg2Ge. Это соединение представляет собой новую фазу и имеет соответствующую однородную область на диаграмме состояния (линия PF на рисунке 1). Линия хим. соединения проходит через точку Р, соответствующую содержанию компонента Ge в Mg2Ge и разделяет общую диаграмму Mg–Ge на две независимые части: Mg–Mg2Ge и Mg2Ge –Ge, каждую из которых можно рассматривать отдельно и для каждой из них соединение Mg2Ge играет роль «компонента».
11.Связь между свойствами сплавов и типом диаграммы состояния Как известно, вид диаграммы состояния зависит от того, какие фазы образуют оба компонента. Свойства сплава также зависят от того, какие соединения или какие фазы образовали компоненты сплава.
Поэтому очевидно, что между видом диаграммы состояния и свойствамисплава должна существовать определенная связь. На рис. приведены четыре основных типа диаграмм состояний и соответствующие им закономерности изменения свойств сплава с изменением концентрации:
1. При образовании смесей (рис. а) Свойства сплава изме няются по линейному закону (аддитивно). Следовательно, значени свойств сплаванаходятся в интервале между свойствами чистых ком понентов.
2. При образовании твердых растворов (рис. б)свойств сплава изменяются по криволинейной зависимости, причем некото рые свойства, в первую очередь электросопротивление, могут значи тельно отличаться от свойств компонентов. Следовательно, при образовании механической смеси электросопротивление повышается незначительно, при образовании твердого раствора — весьма сильно. Поэтому распад твердого раствора на две (или более) фазы приводитк повышению электропроводности (закон Курнакова).
3. При образовании ограниченных твердых растворов (рис. в) свойства в интервале концентраций, отвечающем однофазным твердым растворам, изменяются по криволинейному, а в двухфазной области диаграммы — по прямолинейному закону, причем крайние точки на прямой являются свойствами чистых фаз, предельно насыщенных твердых растворов, образующих данную смесь.
4. При образовании химического соединения на диаграмме концентрация — Свойства (рис. г) концентрация химического соединения отвечает максимуму (или минимуму) на кривой (в данном случае перелом прямой). Эта точка перелома, соответствующая химическому соединению, называется сингулярной (особой) точкой. По диаграмме состав —свойства находим стехиометрическое соотношение компонентов данного химического соединения определяя, какой концентрации отвечает сингулярная точка.
Точное изучение свойств в зависимости от изменения концентраций (т. е. построение диаграммы состав—свойства) является важным дополнением при изучении и построении диаграмм состояний.
Метод изучения изменений свойств в зависимости от изменения состава и построения диаграммы состав — Свойства был положен Н. С. Курнаковым в основу разработанного им физико-химического анализа сплавов. В настоящее время физико-химический анализ является одним из основных методов изучения сплавов и его широко применяют в научных исследованиях новых сплавов при изучении структурных превращений и в других случаях.

12 испытание материалов на растяжение.предел прочности. Предел текучести
Испытания на растяжение являются основным и наиболее распространенным методом лабораторного исследования и контроля механических свойств материалов.
Эти испытания проводятся и на производстве для установления марки поставленной заводом стали или для разрешения конфликтов при расследовании аварий.
В таких случаях, кроме металлографических исследований, определяются главные механические характеристики на образцах, взятых из зоны разрушения конструкции. Образцы изготавливаются по ГОСТ 1497-84 и могут иметь различные размеры и форму (рис. 1.1).
Между расчетной длиной образца lо и размерами поперечного сечения Ао (или dо для круглых образцов) выдерживается определенное соотношение:
- у длинных образцов

- у коротких образцов
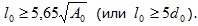
В испытательных машинах усилие создается либо вручную - механическим приводом, либо гидравлическим приводом, что присуще машинам с большей мощностью.
Преде́л про́чности — механическое напряжение, выше которого происходит разрушение материала. Иначе говоря, это пороговая величина, превышая которую механическое напряжение разрушит некое тело из конкретного материала
. Пределом текучести называют механическую характеристику материала, характеризующую напряжение, при котором деформации продолжают расти без увеличения нагрузки. На диаграмме напряжений (рис. 1) обозначается точкой, в которой начинается практически горизонтальный участок диаграммы, называемый площадкой текучести.
13 Измерение твердости металлов по методу Бринеля
Твёрдость - это сопротивление тела внедрению индентора - другого твёрдого тела. Способы испытания твёрдости подразделяются на статические и динамические.
Измерение твёрдости по методу Бринелля основано на вдавливании в испытуемое изделие стального закаленного шарика определенного диаметра, под действием заданной нагрузки в течение определенного времени. При определении твёрдости по методу Бринелля, расстояние от центра отпечатка до края испытуемого изделия должно быть не менее 2,5 диаметров отпечатка, расстояние между центрами двух соседних отпечатков - не менее 4 диаметров; для металлов с твёрдостью до 35НВ эти расстояния должны быть соответственно равны 3 диаметрам отпечатка и 6 диаметрам отпечатка.
Проведение испытаний, методику измерений диаметра отпечатка, а также погрешность измерений диаметра отпечатка регламентирует ГОСТ 9012 п.4.
14 измерение твердости по методу роквелла Измерение твёрдости по методу Роквелла основано на вдавливании алмазного конуса с углом при вершине 120° или стального закаленного шарика диаметром 1,588 мм под действием двух последовательно прилагаемых нагрузок. Расстояние между центрами двух соседних отпечатков должно быть не менее четырех диаметров отпечатка (но не менее 2 мм), расстояние от центра отпечатка до края образца должно быть не менее 2,5 диаметра отпечатка (но не менее 1 мм).
При измерении твёрдости на выпуклых цилиндрических и сферических поверхностях по шкалам А, В, С, D, F, G в результаты измерений твёрдости должны быть введены поправки, величины которых приведены в приложении 3 ГОСТ 9013. Поправки прибавляются к полученным значениям твёрдости.
15 Компоненты и фазы диаграмм состояния железоуглеродстых сплавов
Сплавы железа с углеродом (стали, чугуны) являются наиболее распространенными материалами в машиностроении.
Железо (Fе) – блестящий светло-серый металл. Атомный номер 26, плотность 7870 кг/м3, температура плавления 1539 °C, температура кипения 2880 °C, модуль нормальной упругости 210 ГПа. Механические свойства железа зависят от его чистоты. Временное сопротивление при растяжении технически чистого железа составляет 300…400 МПа, предел текучести σТ=100…250 МПа, относительное удлинение δ=30…50 %, относительное сужение ψ=70…80 %, НВ=60…90 (600…900 МПа).
Углерод (С) в железоуглеродистых сплавах находится в химически связанном или свободном состоянии. Атомный номер 6, плотность 2600 кг/м3, температура плавления 4000 °C, температура кипения 4200 °C. Он имеет две кристаллические модификации – графита и алмаза. При нормальных условиях стабилен графит, он имеет гексагональную решетку; алмаз получается при высоких давлениях и температурах, имеет кубическую (метастабильную) решетку.
В зависимости от температуры и содержания углерода железоуглеродистые сплавы могут образовывать несколько структурных составляющих (фаз).
Феррит (Ф) – твердый раствор внедрения углерода в a-железе, имеет кубическую объемно-центрированную решетку, максимальная растворимость при 727 °C составляет 0,02 % углерода. Феррит магнитен, на диаграмме состояния занимает область GPQ. Феррит характеризуется низкой прочностью (sВ=250 МПа, s0,2=120 МПа) и твердостью (НВ 80…100) и высокой пластичностью (δ=50 %; ψ=80 %).
Аустенит (А) – твердый раствор внедрения углерода в γ-железе, имеет кубическую гранецентрированную решетку. Предельная растворимость углерода в γ-железе при температуре 1147 °C – 2,14 %. Аустенит немагнитен, на диаграмме состояния занимает область АЕSG. Он имеет твердость НВ 160 при d=40…50 %.
Цементит (Ц) – химическое соединение железа с углеродом (карбид железа Fе3С), содержит 6,67 % углерода, температура плавления точно не установлена и принимается примерно равной от 1260 °C до 1600 °C. Цементит магнитен, характеризуется высокой твердостью (>800 НВ) и очень низкой пластичностью. Цементит является метастабильной фазой и при определенных условиях распадается с выделением свободного графита. В зависимости от условий образования различают цементит первичный, который образуется из жидкости при затвердевании расплава, вторичный – образуется при распаде аустенита и третичный – образуется при выделении углерода из феррита.
Графит представляет собой свободный углерод, он мягок, обладает низкой прочностью и электропроводностью. В чугунах и графитизированной стали содержится в виде включений. Форма графитовых включений оказывает влияние на механические и технологические свойства сплавов.
Перлит (П) – эвтектоидная механическая смесь феррита и цементита, содержащая 0,83 % углерода; образуется при 727 °C в результате распада аустенита в процессе его охлаждения: Fеg(С)®Fеa(С)+Fе3С. Перлит может быть пластинчатым или зернистым. Это определяет механические свойства перлита. При комнатной температуре зернистый перлит имеет прочность sВ=800 МПа, пластичность d=15 %, НВ=160…200.
Ледебурит (Л) – эвтектическая механическая смесь аустенита и цементита, образующаяся из жидкого расплава при 1147 °C и при содержании 4,3 % углерода. Твердость НВ 600…700, хрупок. Так как при температуре ниже 727 °C аустенит превращается в перлит, то ледебурит ниже этой температуры состоит из цементита и перлита.
Помимо упомянутых составляющих в железоуглеродистых сплавах могут быть неметаллические включения (соединения с кислородом, азотом, серой, фосфором и др.), которые с железом образуют различные фазы.
Основой для определения структуры и свойств железоуглеродистых сплавов является диаграмма состояния железо – углерод (цементит). На рис. 1 представлен ее упрощенный вариант. Ось абсцисс – двойная, она показывает содержание углерода и цементита. Диаграмма состояния Fе – Fе3С является диаграммой метастабильного равновесия.
Точка А на диаграмме соответствует температуре плавления железа, точка D – цементита. В точке С (с концентрацией 4,3 % углерода и температурой 1147 °C) образуется эвтектика (ледебурит). Линия АСD – линия ликвидус (выше ее существует жидкий раствор L) – показывает начало первичной кристаллизации: по линии АС из жидкого, раствора начинает кристаллизоваться аустенит, по СD – цементит. Поэтому в области АСЕ существует жидкий раствор и кристаллы аустенита (L+А), а в области СDF – жидкий раствор и кристаллы цементита (L+ЦI).
Точка Е диаграммы показывает максимальную растворимость углерода в аустените при температуре 1147 °C, она принята границей деления железоуглеродистых сплавов на стали (до 2,14 % углерода) и чугуны (свыше 2,14 % углерода).
Линия АЕСР – линия солидус – характеризует конец первичной кристаллизации. Она также является началом вторичной кристаллизации (перекристаллизации), характерной для твердой фазы. Прямая ЕСF называется линией эвтектических превращений.
Аллотропия (полиморфизм) железа определяет превращения в сталях при их охлаждении от аустенитного состояния. Точка G диаграммы соответствует температуре аллотропического превращения чистого железа (911 °C). С повышением содержания углерода до 0,8 % температура превращения аустенита в феррит, постепенно снижаясь, достигает 727 °C. Линия GS – начало, линия GР – конец превращения аустенита в феррит, поэтому область GPQ характеризует феррит (Ф). Линия GS может рассматриваться как геометрическое место точек Ас3, Аr3. В точке S (с концентрацией 0,8 % углерода и температурой 727 °C) протекает реакция распада аустенита, продуктом которой является эвтектоидная смесь, называемая перлитом. Поэтому прямая РSК называется прямой эвтектоидных превращений, кроме того, она является геометрическим местом точек Ас1 и Аг1,. В области GSР существуют аустенит и феррит (А+Ф), а в области QРS0,8 – перлит и феррит (П+Ф).
Линия SE является линией ограниченной растворимости углерода в аустените: со снижением температуры растворимость падает с 2,14 до 0,8 %. В связи с этим в сплавах при их охлаждении избыточный углерод выпадает из аустенита в виде карбида железа Fе3С. Поэтому в области SЕЕ' существуют аустенит и цементит вторичный (А + ЦII). Он называется вторичным потому, что он образуется из твердой фазы. Кривая SE также является геометрическим местом точек Аm. В области 0,8SЕ'2,14 существуют перлит и цементит (П+ЦII).
В зависимости от содержания углерода стали делят на доэвтектоидные (с содержанием углерода до 0,8 %), их также можно назвать конструкционными; эвтектоидные (с содержанием углерода 0,8 %) и заэвтектоидные (с содержанием углерода более 0,8 %), последние две группы можно назвать инструментальными сталями.
Структура доэвтектоидных сталей состоит из феррита (белые включения) и перлита (темные включения). С увеличением содержания углерода количество феррита уменьшается, а перлита – увеличивается. Структура эвтектоидной стали состоит из перлита; заэвтектоидных сталей – из перлита (темные участки) и цементита (светлые участки в виде сетки или игл).
В чугунах и первичный аустенит, и аустенит в составе эвтектики к концу кристаллизации содержат максимальное количество углерода (2,14 %). Со снижением температуры до 1147 °C и более избыточный углерод (линия SE) выпадает из аустенита в виде вторичного цементита. Поэтому в области ЕСС'Е' существуют аустенит, ледебурит и вторичный цементит (А+Л+ЦII), а в области СFКС' – ледебурит и первичный цементит (Л+ЦI). По прямой PSK и в чугунах аустенит характеризуется перлитным превращением. Отсюда в области 2,14Е'С'4,3 существуют перлит, ледебурит и вторичный цементит (П+Л+ЦII), а в области C'K6,67 4,3 – ледебурит и первичный цементит (Л+ЦI).
Следует отметить, что линия GPSK является концом вторичной кристаллизации железоуглеродистых сплавов.
В зависимости от содержания углерода чугуны делятся на доэвтектические (с содержанием углерода от 2,14 % до 4,3 %), эвтектические (с содержанием углерода 4,3 %) и заэвтектические (с содержанием углерода более 4,3 %).
Структура белых чугунов состоит из перлита, ледебурита и цементита. Свое название белые чугуны получили по виду излома – матово-белый цвет. Структура доэвтектического чугуна при комнатной температуре состоит из ледебурита, перлита и вторичного цементита (ледебурит – светлые участки с расположенными на них зернами перлита; перлит – более крупные темные зерна; вторичный цементит – светлые участки, сливающиеся с цементитом ледебурита). Структура эвтектического чугуна состоит из перлита и первичного цементита (в виде крупных светлых продолговатых кристаллов). Структура заэвтектического чугуна состоит из ледебурита и первичного цементита (в виде крупных светлых полос).
16 диаграмма состояния железоуглеродистых сплавов и его практическое применение Диаграмму состояния сплавов системы железо—цементит применяют для определения режима термической обработки сплава, температуры нагрева металла под ковку и температурного предела ковки, а также температуры плавления, что необходимо для назначения режима заливки жидкого сплава в формы.
Термическая обработка производится путем нагрева металлических сплавов до определенных температур, выдержки при этих температурах и последующего быстрого или медленного охлаждения с целью изменения свойств сплава в желаемом направлении.
Термическая обработка железоуглеродистых сплавов имеет ряд разновидностей, основанных на том, что неустойчивая при низких температурах структура аустенита в зависимости от скорости охлаждения сплава превращается в структуры, обладающие различными свойствами.
Продуктами распада аустенита являются мартенсит, троостит, сорбит и перлит.
Мартенсит — продукт закалки аустенита и его превращения в феррит без выделения углерода из раствора. Поэтому мартенсит — это сильно пересыщенное углеродом α-железо с кпженной кристаллической решеткой. Эго обусловливает высокую его твердость (НВ 600—700) и прочность, повышенную и ость и наличие внутренних напряжений. Эта структура образуется при больших скоростях охлаждения — закалки (180 ÷ сек для углеродистой стали). Мартенсит по своей природе неустойчив и при нагреве до температуры свыше 70° стремится перейти в другие структуры.
Трооститом называется механическая смесь феррита цементита очень высокой степени дисперсности. Твердость троостита НВ 350÷500. Эта структура образуется при скорости закалки углеродистой стали около 80°/сек. Игольчатый троостит иногда называют бейнитом.
Сорбит — это более грубая механическая смесь зерен феррита и цементита, однако достаточно дисперсная. Она с трудом различается под обычным микроскопом. Твердость сорбита 250÷350. Эта структура образуется при скоростях закалки углеродистой стали менее 50°/сек. По сравнению с трооститом copбит имеет более высокую вязкость, а по сравнению с перлитом — большую твердость.
Перлит представляет собой более или менее грубую механическуюкую смесь феррита и цементита. Перлит образуется при малых Коростях охлаждения стали, нагретой до аустенитногосостояния.
Троостит, сорбит и перлит можно получить путем отпуска мартенсита при возрастающих температурах отпуска. В этом случае они имеют отличные, часто более высокие механические свойства, чем при охлаждении аустенита с разными скоростями.
Таким образом, путем изменения режима термической обработки можно получать различные физико-механические свойства и структуры стали. К операциям термической обработки относятся отжиг, нормализация, закалка и отпуск.
17.Влияние углерода и примисей на свойства железоуглеродистых сплавов Стали: влияние углерода и примесей на свойства сталей. Классификация и маркировка сталей
Стали являются наиболее распространёнными материалами. Обладают хорошими технологическими свойствами. Изделия получают в результате обработки давлением и резанием.
Достоинством является возможность получать нужный комплекс свойств, изменяя состав и вид обработки. Стали, подразделяют на углеродистые и легированные.
Влияние углерода и примесей на свойства сталей
Углеродистые стали являются основными. Их свойства определяются количеством углерода и содержанием примесей, которые взаимодействуют с железом и углеродом.
Влияние углерода
С ростом содержания углерода в структуре стали увеличивается количество цементита, при одновременном снижении доли феррита. Изменение соотношения между составляющими приводит к уменьшению пластичности, а также к повышению прочности и твердости. Прочность повышается до содержания углерода около 1%, а затем она уменьшается, так как образуется грубая сетка цементита вторичного.
Углерод влияет на вязкие свойства. Увеличение содержания углерода повышает порог хладоломкости и снижает ударную вязкость.
Повышаются электросопротивление и коэрцитивная сила, снижаются магнитная проницаемость и плотность магнитной индукции.
Углерод оказывает влияние и на технологические свойства. Повышение содержания углерода ухудшает литейные свойства стали (используются стали с содержанием углерода до 0,4 %), обрабатываемость давлением и резанием, свариваемость. Следует учитывать, что стали с низким содержанием углерода также плохо обрабатываются резанием.
Влияние примесей.
В сталях всегда присутствуют примеси, которые делятся на четыре группы. 1. Постоянные примеси: кремний, марганец, сера, фосфор.
Марганец и кремний вводятся в процессе выплавки стали для раскисления, они являются технологическими примесями.
Содержание марганца не превышает 0,5…0,8 %. Марганец повышает прочность, не снижая пластичности, и резко снижает красноломкость стали, вызванную влиянием серы. Он способствует уменьшению содержания сульфида железа FeS, так как образует с серой соединение сульфид марганца MnS. Частицы сульфида марганца располагаются в виде отдельных включений, которые деформируются и оказываются вытянутыми вдоль направления прокатки.
Содержание кремния не превышает 0,35…0,4 %. Кремний, дегазируя металл, повышает плотность слитка. Кремний растворяется в феррите и повышает прочность стали, особенно повышается предел текучести, . Но наблюдается некоторое снижение пластичности, что снижает способность стали к вытяжке
Содержание фосфора в стали 0,025…0,045 %. Фосфор, растворяясь в феррите, искажает кристаллическую решетку и увеличивает предел прочности и предел текучести, но снижает пластичность и вязкость.
Располагаясь вблизи зёрен, увеличивает температуру перехода в хрупкое состояние, вызывает хладоломкость, уменьшает работу распространения трещин, Повышение содержания фосфора на каждую 0,01 % повышает порог хладоломкости на 20…25ºС.
Фосфор обладает склонностью к ликвации, поэтому в центре слитка отдельные участки имеют резко пониженную вязкость.
Для некоторых сталей возможно увеличение содержания фосфора до 0,10…0,15 %, для улучшения обрабатываемости резанием.
Сера уменьшает пластичность, ухудшает свариваемость и коррозионную стойкость.
Содержание серы в сталях составляет 0,025…0,06 %. Сера – вредная примесь, попадает в сталь из чугуна. При взаимодействии с железом образует химическое соединение – сульфид серы FeS, которое, в свою очередь, образует с железом легкоплавкую эвтектику с температурой плавления 988ºС. При нагреве под прокатку или ковку эвтектика плавится, нарушаются связи между зёрнами. При деформации в местах расположения эвтектики возникают надрывы и трещины, заготовка разрушается – явление красноломкости.
Красноломкость – повышение хрупкости при высоких температурах
Сера снижает механические свойства, особенно ударную вязкость аи пластичность (и), а также предел выносливости. Она ухудшают свариваемость и коррозионную стойкость.
2. Скрытые примеси — газы (азот, кислород, водород) – попадают в сталь при выплавке.
Азот и кислород находятся в стали в виде хрупких неметаллических включений: окислов (FeO, SiO2 , Al2O3) нитридов (Fe 2N), в виде твердого раствора или в свободном состоянии, располагаясь в дефектах (раковинах, трещинах).
Примеси внедрения (азот N, кислород О) повышают порог хладоломкости и снижают сопротивление хрупкому разрушению. Неметаллические включения (окислы, нитриды), являясь концентраторами напряжений, могут значительно понизить предел выносливости и вязкость.
Очень вредным является растворенный в стали водород, который значительно охрупчивает сталь. Он приводит к образованию в катанных заготовках и поковках флокенов.
Флокены – тонкие трещины овальной или округлой формы, имеющие в изломе вид пятен – хлопьев серебристого цвета.
Металл с флокенами нельзя использовать в промышленности, при сварке образуются холодные трещины в наплавленном и основном металле.
Если водород находится в поверхностном слое, то он удаляется в результате нагрева при 150…180, лучше в вакууме мм рт. ст.
Для удаления скрытых примесей используют вакуумирование.
3. Специальные примеси, которые специально вводятся в сталь для получения заданных свойств. Примеси называются легирующими элементами, а стали — легированные сталями.
18 Макроструктурный анализ металлов
Макроструктура - строение металлов и сплавов, выявляемое невооруженным глазом или лупой (´30) на шлифованных и/или протравленных образцах. Макростру
Воспользуйтесь поиском по сайту:  ©2015 - 2026 megalektsii.ru Все авторские права принадлежат авторам лекционных материалов. Обратная связь с нами...
|

