 |
Буферной ёмкостью (в) называется число моль-эквивалентов сильной кислоты или щелочи, которые нужно добавить к 1 л буферного раствора, чтобы изменить величину рн на единицу.
|
|
|
|
Интервал значений рН выше и ниже которого буферное действие прекращается, называется зоной буферного действия.
Изменение величины рН буферной системы при этом составляет ± 1: рН = рК ± 1. Соотношение концентраций компонентов буферной смеси может лежать в пределах: 10 › Ск/Сс › 0,1.
Например, если взять раствор, содержащий 1 моль СН3СООН и 0,1 моля СН3СООNa в литре ( = 10), и второй раствор, содержащий 0,1 моля СН3СООН и 1 моль СН3СООNa в литре (
= 10), и второй раствор, содержащий 0,1 моля СН3СООН и 1 моль СН3СООNa в литре ( =
=  ), то в первом растворе:
), то в первом растворе:
рН = рК( – lg10 = рК(
– lg10 = рК( - 1,
- 1,
а во втором растворе:
рН = рК( – lg0,1 = рК(
– lg0,1 = рК( + 1.
+ 1.
В том случае, когда в качестве буферного раствора применяют смесь кислой и средней соли, например NaHCO3 и Na2CO3, концентрацию гидрокарбоната-иона HC  можно считать равной концентрации кислой соли, а концентрацию карбонат-иона – концентрацией средней соли. Концентрацию ионов водорода в этом случае вычисляют по следующей формуле:
можно считать равной концентрации кислой соли, а концентрацию карбонат-иона – концентрацией средней соли. Концентрацию ионов водорода в этом случае вычисляют по следующей формуле:
[H+] = 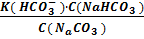
При С(NaHCO3) = C(Na2CO3) концентрация ионов водорода равна:
[H+] = К(НСО3-).
В качестве буферного раствора может также служить раствор двух кислых солей, соответствующих различным ступеням нейтрализации многоосновной кислоты, например NaH2PO4 и Na2HPO4. В этом случае первая соль даёт кислоту [H2PO4]-. А вторая является соответствующей этой кислоте солью или сопряженным основанием [HPO4]2-.
Фосфатные буферные растворы могут быть составлены из смесей следующих веществ: 1) H3PO4 + Na2HPO4; 2) Na2HPO4 + Na2HPO4; 3) Na2HPO4 + Na3PO4. В случае равенства концентраций компонентов в этих растворах для первой смеси рН = рК(H3PO4); для второй рН = рК{[H2PO4]-}; для третьей рН = рК{[HPO4]2-}.
В некоторых случаях для приготовления буферной смеси с определённым значением рН смешивают два буферных раствора. Например, для получения буфера с рН, равным 7,35, смешивают карбонатный буфер (гидрокарбонат – карбонат) с фосфатным (гидро- и дигидрофосфат).
|
|
|
Отметим, что при разбавлении буферных растворов концентрация ионов водорода, а, следовательно, рН почти не изменяется, так как отношение  При разбавлении растворов сильных кислот или сильных щелочей концентрация ионов водорода резко уменьшается, а при разбавлении раствора слабых кислот или щелочей уменьшается в значительно меньшей степени.
При разбавлении растворов сильных кислот или сильных щелочей концентрация ионов водорода резко уменьшается, а при разбавлении раствора слабых кислот или щелочей уменьшается в значительно меньшей степени.
Буферные растворы с устойчивыми значениями рН в интервале от 7 до 10 можно получить, смешав какое-либо основание с одной из его солей. Типичным примером буферного раствора такого типа является раствор аммиака и хлорида аммония. В водном растворе хлорид аммония полностью диссоциирует
NH4Cl(водн.) → [NH4]+ (водн.) + Cl-(водн.)
Аммиак диссоциирует в воде лишь частично
NH3(водн) + H2O(ж.) ↔ [NH4]+ (водн.) + ОН-(водн.)
При добавлении кислоты в этот буферный раствор она нейтрализуется ионами ОН-. Вследствие этого равновесие процесса диссоциации аммиака смещается вправо. Этот сдвиг поддерживает постоянную концентрацию ионов ОН-, и, следовательно, будет постоянным значение рН.
При добавлении основания равновесие смещается влево равновесие смещается влево, и концентрация ионов ОН- поддерживается постоянной. Наличие в буферном растворе хлорида аммония обеспечивает в нём большой запас ионов NH4+, позволяющий компенсировать влияние добавляемых порций основания.
Уравнение Гендерсона для буферного раствора, содержащего слабое основание и одну из его солей, имеет вид:
рН = рКВ – рКb + lg( )
)
ФОРМУЛЫ ДЛЯ РАСЧЁТА рН БУФЕРНЫХ РАСТВОРОВ ПРИ ДОБАВЛЕНИИ К НИМ КИСЛОТ ИЛИ ОСНОВАНИЙ
рН = рК + lg 
рН = рК + lg 
БУФЕРНАЯ ЁМКОСТЬ
Буферные системы способны поддерживать постоянным значение рН среды только при добавлении к ним небольших количеств кислоты или щёлочи. Для количественной характеристики сопротивляемости буферных растворов к добавлению кислот или оснований введено понятие «буферная ёмкость»:
|
|
|
БУФЕРНОЙ ЁМКОСТЬЮ (В) называется число моль-эквивалентов сильной кислоты или щелочи, которые нужно добавить к 1 л буферного раствора, чтобы изменить величину рН на единицу.
Различают буферную ёмкость по кислоте Ва и буферную ёмкость по основанию Вв, которые рассчитываются с помощью уравнений:
Ba =  и Вb =
и Вb = 
где Н – нормальная концентрация эквивалентов, а V – объём добавленной кислоты (щелочи); ∆рН – сдвиг водородного показателя буферного раствора, вызванный добавлением сильной кислоты (щелочи); V – исходный объём буферного раствора.
Буферная емкость зависит от концентраций компонентов в буферном растворе и их отношения. Чем выше концентрация компонентов, тем больше буферная емкость.
Кислотная буферная ёмкость определяется концентрацией буферного основания, т.е. концентрацией акцептора протона: Ва = f([акцептор протона]).
Основная буферная ёмкость определяется концентрацией буферной кислоты, т.е. концентрацией донора протона: Вв =f([донор протона]).
При разбавлении буферного раствора величина буферной ёмкости уменьшается вследствие снижения концентрации всех компонентов раствора.
При одинаковой суммарной концентрации компонентов буферная емкость достигает максимального значения при равенстве их концентраций: [донор протона] = [ акцептор протона], причём в этом случае Ва = Вв, а рН = рКа.
|
|
|


