 |
Уравнения Клапейрона и Клапейрона – Клаузиуса
|
|
|
|
Для однокомпонентных равновесных двухфазных систем зависимость между давлением, температурой, объемом и теплотой фазового перехода или полиморфного превращения (∆Hф. п.) можно определить аналитически.
Как известно, если в ходе процесса изменение числа молей компонента i в какой-либо фазе (при постоянстве давления, температуры и числа молей остальных компонентов) равно единице (∆N i =1), то изменение энергии Гиббса этой фазы равно химическому потенциалу i -гокомпонента µi
(∆G = µi).
Для однокомпонентной системы при p, T = const термодинамическим условием равновесия фаз является равенство химических потенциалов вещества во всех трех фазах:
µI =µII =µIII или dGI = dGII = dGIII ,
а поскольку в отсутствии химических превращений в системе
dG =−SdT +Vdp, то−S IdT + V Idp =−S II dT + V II dp,
или
∆Sф.п. dT =∆Vф.п.dp,
где
∆Sф. п. = S II − SI , а ∆Vф.п. = V II −VI
Изменение энтропии объема при фазовых переходах или полиморфных превращениях. Тогда
Изотермические фазовые переходы и полиморфные превращения можно считать обратимыми процессами, поэтому, в соответствии со вторым началом термодинамики,
∆Sф. п. =∆Q ,
Где ∆Q – теплота процесса. А так как в изобарных условиях ∆Qр=∆H, то
dp=∆Hф. п. . (3.6) dT T∆Vф.п.
Это уравнение, применимое к любому двухфазному равновесному превращению, называется уравнениемКлапейрона.
При равновесии двух конденсированных фаз - твердое↔жидкое или твердое (модификация I) ↔ твердое (модификация II) – молярные объемы фаз сравнимы по величине. Так, молярный объем жидкой меди всего на 3% больше, чем твердой. Но при равновесиях твердое↔пар или жидкое↔пар в условиях, далеких от критических, молярный объем конденсированной фазы всегда значительно меньше, чем парообразной. Например, 10 молей воды при нормальных условиях в виде жидкости имеют объем 0,18 л, а в виде пара - 224 л, что почти в 1250 раз больше. Это позволяет преобразовать уравнение Клапейрона для процессов испарения и возгонки.
|
|
|
Для области давлений не более 5⋅106 Па, в которой пар подчиняется законам идеальных газов, можно принять:
Вставить формулы
Это уравнение является частным случаем выражения (3.6) для процессов испарения и возгонки называется уравнением Клапейрона–Клаузиуса.
Интегрирование уравнения Клапейрона-Клаузиуса при условиях, когда ∆Hф. п. можно считать независящей отт емпературы, приводит к выражению:
∫d ln p = ∆Hисп.(возг.) ∫dT2 +const,RT
ln p =− ∆Hисп.(возг.) +const, (3.8)
RT
или, если обозначить ∆Hисп.(возг.) =B, аconst =A, тоlg p =A −B .
Согласно этим уравнениям, зависимость давления насыщенного пара от температуры в координатах lg p =f (1  T) является линейной (рис. 3.5).
T) является линейной (рис. 3.5).
 1 11рис. 3.5, 0
1 11рис. 3.5, 0
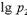

Если измерить давление насыщенного пара при различных температурах или температуру кипения (возгонки) при различных давлениях и построить прямую,как показано на рис. 3.5., то можно вычислить молярную теплоту испарения, т.е. количество теплоты, поглощенноевеществом при изотермическом испарении одного моля жидкости, находящейся в равновесии со своим паром. Аналогичным путем определяется и молярная теплота возгонки.
∆Hисп.(возг.)=2,3R lgp 11−−lg1 p2 =2,3R T1 T1 − TT2 2 lg pp12. (3.9)
В некоторых случаях пользуются не молярными теплотами испарения, возгонки, плавления ∆H, которые измеряются в кДж/моль, а удельными теплотами ∆h, которые относятся к 1 кг испаряемого вещества и измеряются в кДж/кг:
∆h =∆H ⋅1000/ M, (3.10)
где M – молярная масса вещества (г/моль).
Процессы испарения, возгонки и плавления являются эндотермическими (∆H>0); они идут с поглощением теплоты, которая расходуется на разрыв связей между молекулами жидкости при испарении или на разрушение кристаллической решетки при возгонке и плавлении.
|
|
|
При испарении и возгонке величина ∆Vисп.(возг.)>0 (а Tф.п. всегда больше нуля), поэтому знак производной d ln p  dT, как следует из уравнения (3.7), тоже положителен.
dT, как следует из уравнения (3.7), тоже положителен.
Из рис. 3.3 - 3.5 видно, что всегда при росте температуры (dT > 0) давление насыщенного пара над жидкостью и твердым веществом увеличивается (dp > 0). При этом, поскольку ∆Hвозг. =∆Hпл. +∆Hисп.,
∆Hвозг. >∆Hпл., криваяв озгонки AB идет круче кривой испарения AK (рис. 3.3 и 3.4). Следовательно, давление насыщенного пара с увеличением температуры растет сильнее над твердой фазой, чем над жидкой.
При плавлении изменение объема ∆Vф.п. может быть и больше, и меньше нуля. Как правило, молярный объем жидкой фазы больше, чем твердой
(Vж. > Vтв.), и с ростом внешнего давления температура плавления увеличивается: dp  dT > 0 (рис. 3.3 а). Но для некоторых веществ (H2O, Bi, Ga и ряда сплавов) наблюдается обратная зависимость (Vж. < Vтв. и
dT > 0 (рис. 3.3 а). Но для некоторых веществ (H2O, Bi, Ga и ряда сплавов) наблюдается обратная зависимость (Vж. < Vтв. и
dp  dT < 0). Поэтому кривые плавления AD (рис. 3.3 а и 3.3 b) имеют различный уклон.
dT < 0). Поэтому кривые плавления AD (рис. 3.3 а и 3.3 b) имеют различный уклон.
Во всех случаях, в соответствии с принципом Ле–Шателье, увеличение давления при постоянной температуре смещает фазовое равновесие в сторону того из процессов, который сопровождается уменьшением объема V (увеличением плотности ρ) системы. Например, из рис. 3.3 следует, что для серы при постоянной температуре Vж > Vм > Vри ρ ж < ρ м < ρ р.
|
|
|


