 |
с платиновым вращающимся электродом
|
|
|
|
На рисунке 2.14 представлена схема установки для амперометрического титрования с платиновым вращающимся электродом.

Рисунок 2.14 – Схема установки для амперометрического титрования
с платиновым вращающимся электродом:
1 – микробюретка; электролизёр; 2 - платиновый электрод с мешалкой; 3 - электродвигатель; 4 - каломельный электрод; 5 - солевой мостик; 6 – гальванометр; 7- вольтметр; 8 - потенциометр; 9 - источник питания (батарея на 4,3 В)
Лабораторная работа № 5
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ СУЛЬФАТ-ИОНОВ
В РАСТВОРЕ МЕТОДОМ ПРЯМОЙ КОНДУКТОМЕТРИИ
| Цель работы: | определить концентрацию сульфата натрия в анализируемом растворе. |
| Реактивы: | сульфат натрия (х.ч.). |
| Посуда: | мерные колбы вместимостью 50 см3 (6 шт.), капельницы, резиновые пробки, электролитическая ячейка, кондуктометр марки ОК–102/1. |
Определение основано на измерении электропроводности анализируемого раствора, содержащего сульфат-ионы.
Выполнение работы
Приготавливают 500 см3 раствора Na2SO4 молярной концентрации 0,2 моль/дм3. Затем из данного раствора готовят растворы с молярной концентрацией 0,15; 0,1; 0,07; 0,04; 0,02; 0,01 моль/дм3. Для этого в 6 мерных колб вместимостью 50 см3 помещают 30, 25, 17,5; 10, 5, 2,5 см3 раствора Na2SO4, молярной концентрации 0,2 моль/дм3, разбавляют дистиллированной водой до метки и тщательно перемешивают содержимое колб. Измеряют электропроводность полученных растворов, помещая в кондуктометрическую ячейку последовательно растворы из всей мерных колб, начиная с меньшей концентрации раствора. Электропроводность каждого раствора одной и той же концентрации должна измеряться 5 раз и определяется среднее арифметическое значение электропроводности.
Затем у лаборанта в мерную колбу получают анализируемый раствор, разбавляют водой до метки и определяют его электропроводность описанным выше методом (5 раз).
|
|
|
Расчет результатов анализа
1) Результаты измерения электропроводности стандартных и анализируемого растворов Na2SO4 приведены в таблице 1.
Таблица 1 – Результаты экспериментов
| Концентрация раствора Na2SO4, моль/дм3 | Электропроводность G, См | |||||
| Среднее | ||||||
| Анализируемый р-р |
2) Построение калибровочного графика и определение концентрации анализируемого раствора.
Калибровочный график строится по результатам, приведенным в таблице 1.
|
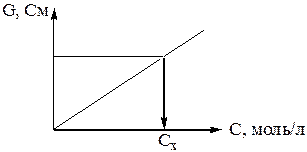
Результат проверяют у преподавателя или лаборанта, оформляют отчет по выполненной работе.
Лабораторная работа № 9
АНАЛИЗ СМЕСИ ПРОТОЛИТОВ В НЕВОДНЫХ СРЕДАХ
МЕТОДОМ ПОТЕНЦИОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
| Цель работы: | определить массовое содержание сильного и слабого протолита в анализируемой смеси. |
| Реактивы: | исходный раствор КОН, ацетон, бензойная кислота, анализируемая смесь протолитов. |
| Посуда: | аналитические весы, потенциометр, стеклянный и каломельный электроды, магнитная мешалка, стаканы вместимостью 50 см3. |
Выполнение работы
1. Потенциометр включают в электрическую сеть. Тумблер включения ставят в положение “ВКЛ.”. прибор прогревается в течение 15 мин. Выключают прибор только после окончания работы. Переключатель “Виды работ” ставят в положение “мВ”.
2. Сухой стакан для титрования взвешивают на аналитических весах, затем повторяют взвешивание с навеской бензойной кислоты (0,05-0,07 г), по результатам взвешивания рассчитывают точную навеску.
3. Навеску растворяют в 20 см3 ацетона. В стакан для титрования аккуратно опускают мешалку и погружают электроды в раствор так, чтобы шарик стеклянного электрода находился на расстоянии не менее 5 см3 от мешалки. Если при этом покрыто менее половины стеклянного шарика, то для погружения шарика следует добавить в стакан воды.
|
|
|
4. Промыть бюретку дистиллированной водой, затем раствором титранта. После этого заполнить бюретку титрантом до нулевого деления при заполненном кончике бюретки.
5. В начале процесса титрования бензойной кислоты титрант (КОН) добавляют (до 2 см3) порциями по 0,5 см3, а затем – по 0,2 см3. После скачка потенциала в точке эквивалентности необходимо сделать ещё 6-7 замеров рН, добавляя титрант по 0,2 см3.
6. Проводят титрование смеси кислот, указанной преподавателем. В стакан для титрования получают анализируемую смесь, добавляют 20 см3 дистиллированной воды и проводят титрование: сначала ориентировочное, добавляя титрант по 0,5 см3, затем точное, добавляя титрант по 0,2 см3.
7. Помещают анализируемую смесь в стакан для титрования и проводят неводное титрование. Для этого в смесь вводят 20 см3 ацетона (проверить правильность расположения электродов) и титруют аналогично п.6.
Расчет результатов анализа
1) Определение концентрации раствора титранта (КОН).
Таблица 1 – Результаты эксперимента
| Объем титранта, см3 | Значение потенциала, мВ |
На миллиметровке вычерчивают кривую титрования в координатах потенциал Е (мВ) – объём титранта V (см3). Находят на ней точку эквивалентности как точку перегиба, пользуясь методом трёх касательных, или более точно – как точку, соответствующую максимальной степени крутизны кривой титрования.
По точному объёму КОН, израсходованному на титрование до точки эквивалентности, рассчитывают концентрацию титранта:
 ,
,
где mб.к. – навеска бензойной кислоты, г;
Mб.к. – молярная масса эквивалента бензойной кислоты, Mб.к.= 122,12;
V – объём щёлочи, израсходованный на титрование, см3.
2) Определение суммарного содержания кислот в анализируемой смеси.
Таблица 2 – Результаты определения суммарного содержания кислот
|
|
|


