 |
Химическая кинетика и химическое равновесие
|
|
|
|
Пример 1. Во сколько раз изменится скорость реакции 2СО (г) +О2 (г) ó 2CO2 (г)при увеличении давления в системе в 10 раз? Температура системы поддерживается постоянной.
Решение. Предположим, что рассматриваемая реакция является элементарной, т.е. для нее справедлив закон действующих масс:
v1 = k×c2(CO)×c(O2).
Принимая, что концентрация и парциальное давление связаны прямо пропорциональной зависимостью
рi = сi.RT,
получаем, что v = k×p2(CO)×p(O2).
После увеличения давления в системе в 10 раз парциальное давление каждого из реагентов возрастает тоже в 10 раз, т.е.
v2 = k×(10p(CO))2×(10p(O2)) = 1000× k×p2(CO)×p(O2).
Отсюда  = 1000.
= 1000.
Следовательно, скорость реакции увеличивается в 1000 раз.
Пример 2. Реакция при температуре 30 0С протекает за 1,5 мин. За сколько времени закончится эта реакция при температуре 40 0С, если в данном температурном интервале коэффициент скорости реакции равен 3?
Решение. При увеличении температуры с 30 до 40 0С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:  , где v(T2), v(T1) - скорости реакций при заданных температурах
, где v(T2), v(T1) - скорости реакций при заданных температурах  , т.е. скорость реакции увеличивается в 3 раза.
, т.е. скорость реакции увеличивается в 3 раза.
В соответствии с определением скорость реакции обратно пропорциональна времени реакции:  , где t(Т2), t(Т1) - время реакции при температурах Т1 и Т2.
, где t(Т2), t(Т1) - время реакции при температурах Т1 и Т2.
t(Т2)=  .
.
Учитывая, что t(Т1)= 1,5 мин=90 с, определяем время реакции при температуре Т2: t(Т2)= 30 с.
Таким образом, правило Вант-Гоффа соблюдается, что при повышении температуры на каждые 10 0С приводит к повышению скорости химической реакции в 3 раза (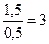 ).
).
Пример 3. Запишите выражение для константы химического равновесия гетерогенной химической реакции H2 (г) + I2 (к) ó 2HI (г). В каком направлении сместится равновесие данной химической реакции при увеличении общего давления в пять раз?
|
|
|
 |
Решение. Константу гетерогенного химического равновесия можно записать через отношение равновесных концентраций или равновесных парциальных давлений газообразных реагентов:
При увеличении общего давления в пять раз парциальные давления газообразных реагентов водорода и иодида водорода увеличатся в пять раз. Скорость прямой реакции при этом увеличится в пять раз, а обратной реакции – в 25 раз. Следовательно, равновесие в данной гетерогенной реакции сместится влево, количество получаемого продукта иодида водорода уменьшится в пять раз.
Пример 4. Вычислить равновесные концентрации компонентов в обратимой реакции СО(г) + Н2О(г) ó CO2 (г) + Н2 (г), если в исходной смеси концентрации СО и Н2О составляли 2 и 3 моль/л соответственно. Кс =1.
Решение. Согласно стехиометрическому уравнению составим состав системы во времени в виде таблицы:
| Компоненты | СО | Н2О | СО2 | Н2 |
| Исходные концентрации | 2 | 3 | - | - |
| Прореагировало | х | х | - | - |
| Образовалось | - | - | х | х |
| Равновесные концентрации | 2-х | 3-х | х | х |
 |
Запишем выражение для константы равновесия:
Решая квадратное уравнение получим х = 1,2 моль/л. Поскольку прореагировало 1,2 моль/л СО и Н2О, то их концентрации к моменту равновесия (равновесные концентрации) составят: [CO] = 2-1,2 = 0,8; [H2O] = 3-1,2 = 1,8 моль/л, а равновесные концентрации [H2] и [CO2] будут равны по 1,2 моль/л.
Пример 5. В гомогенной реакции:
2NO(г) + O2(г) = 2NO2(г)
начальные концентрации составляли: С0(NO) = 0,1 моль/л; С0(O2) = 0,08 моль/л. Вычислите концентрации всех веществ в тот момент, когда концентрация O2 уменьшилась на 0,02 моль/л (Cτ).
Решение.
1. Рассчитаем концентрации исходных веществ к моменту времени, когда прореагировало 0,02 моль/л О2:
ΔС(O2) = С0(O2) – Cτ(O2) = 0,08 – 0,02 = 0,06 моль/л.
Согласно уравнению реакции 2 моль NO реагирует с 1 моль О2, поэтому
|
|
|
ΔС(NO) = С0(NO) – 2Cτ(O2) = 0,1 – 0,04 = 0,06 моль/л, та
2. Согласно же уравнению реакции из 2 моль NO образуется 2 моль NO2 (при условии, что в исходной смеси 0 мол/л NO2), то концентрация образующегося NO2 будет равна концентрации прореагированного NO и составит:
С(NO2)= 0,04 моль/л.
Пример 6. В реакции первого порядка А ® В + С константа скорости k1 = 5×10-5 с-1. Определите концентрацию веществ А и В и скорость реакции через 1 ч и через 5 ч, если начальная концентрация А составляла 0,2 моль/л.
 |
Решение. Для реакции 1-го порядка справедливо уравнение
через 1 ч: 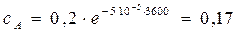 моль/л;
моль/л;
через 5 ч:  моль/л.
моль/л.
Концентрация вещества В находится по стехиометрическому соотношению веществ А и В. из уравнения реакции следует, что концентрация вещества В возрастет на ту же величину, на какую убывает концентрация А, так как из моль вещества А получается 1 моль В.
Поэтому через 1 час сВ = со(А) – сА = 0,2 – 0,17 = 0,03 моль/л;
через 5 ч сВ = со(А) – сА = 0,2 – 0,08 = 0,12 моль/л.
 |
Рассчитаем скорость реакции по уравнению:
через 1 ч: v = 5 × 10-5× 0,17 = 8,5×10-6 моль/л;
через 5ч: v= 5 × 10-5× 0,08 = 4×10-6 моль/л.
Пример 7. В реакции второго порядка А + В ® D за 1 ч концентрации веществ А и В уменьшились по сравнению с начальной со(А)=со(В) = 0,2 моль/л на 30%. Определите константу скорости и скорость реакции в начальный момент времени и через 1 ч после начала реакции.
Решение. Концентрации веществ А и В за 1 ч уменьшились на 0,3× со = 0,3×0,2 = 0,06 моль/л. Отсюда через час концентрации составляют
сА = сВ = 0,2 – 0,06 = 0,14 моль/л.
Для реакции второго порядка
 |
Отсюда
Скорость реакции в начальный момент времени будет равна
v = k2×[A]×[B] = 5,95×10-4×0,2×0,2=2,38×10-5 моль×с-1×л-1.
Через один час скорость реакции уменьшится и составит
vt = k2×[A]×[B] = 5,95×10-4×0,14×0,14=1,16×10-5 моль×с-1×л-1.
Пример 8. В сосуд объемом 0,1 м3 введено 10 г водорода и 84 г азота. К моменту достижения равновесия в системе образовалось 34 г аммиака. Определите константу равновесия реакции Кс.
Решение. Реакция взаимодействия водорода и азота
3H2 (г) + N2 (г) = 2NH3 (г)
 |  |
Рассчитаем концентрацию реагентов в начальный момент времени. 10 г водорода составляет 5 моль, а 84 г азота – 3 моль. соответственно концентрации этих веществ:
|
|
|
 |
Начальная концентрация продуктов реакции с(NH3) = 0. К моменту равновесия концентрация аммиака составила
 |
В соответствии со стехиометрической реакцией для образования 0,02 моль/л аммиака должны прореагировать 0,03 моль водорода и 0,01 моль азота. Следовательно, равновесные концентрации этих газов [H2] = 0,05-0,03 = 0,02 моль/л, [N2] = 0,03 –0,01 = 0,02 моль/л. таким образом константа равновесия
Пример 9. Определите константу равновесия реакции N2O4 (г) = 2NO2 (г) и направление реакции при 400 К, если в начальном состоянии р(N2O4) = 0,5; р(NO2) = 0,8.
Решение. При расчете стандартного изменения энергии Гиббса DG0400 пренебрежем зависимостью DН0 и DS0 от температуры:
DrH0 = 2×DfH0298(NO2) – DfH0298(N2O4) = 2×33,5 - 9,66 = 57,34 кДж,
DrS0 = 2×S0298(NO2) – S0298(N2O4) = 2×240,45 - 304,3 = 176,6 Дж/К,
DrG0 = DrH0 – TDrS = 57340 – 400 × 176,6 = -13300 Дж.
 |
Константу равновесия определим по уравнению:
 |
Начальные условия отличаются от стандартных, следовательно, необходимо определить знак DG400 для заданных условий. Для этого воспользуемся уравнением:
 |
Соотношение давлений
 существенной меньше Кр = 54,7, поэтому реакция будет протекать в прямом направлении. Кроме этого,
существенной меньше Кр = 54,7, поэтому реакция будет протекать в прямом направлении. Кроме этого,
изменение энергии Гиббса отрицательно, следовательно, самопроизвольный процесс из заданного начального состояния возможен только в прямом направлении, т.е. в сторону образования NO2.
Пример 10. Гетерогенная реакция идет по уравнению:
4HCl(г) + O2 (г) = 2H2O(ж) + 2Cl2(г)
Через некоторое время после реакции концентрации участвующих веществ были (моль/л): [HCl] = 0,75; [O2]= 0,42; [Cl2] = 0,20. Рассчитайте концентрации исходных вещество (С0) и скорость прямой реакции  в начальный момент, если
в начальный момент, если  = 1.
= 1.
Решение.
1. Реакция протекает в газовой фазе, поэтому будут учитываются концентрации только газообразных веществ. Поскольку в начальный момент продуктов реакции не было, значит С0(Cl2) = 0 и ΔС(Cl2) = Cτ (Cl2) = 0,20 моль/л.
2. ΔС(O2) =  0,1 моль/л.
0,1 моль/л.
3. С0(O2) = Cτ (O2) + ΔС(O2) = 0,42 + 0,1 = 0,52 моль/л.
4. ΔС(HCl) =  0,4 моль/л.
0,4 моль/л.
5. С0(HCl) = Cτ (HCl) + ΔС(HCl) = 0,75 + 0,4 = 1,15 моль/л.
|
|
|
6.  =
= 
 = 1·1,154·0,52 = 0,91.
= 1·1,154·0,52 = 0,91.
Пример 11. При температуре 280 0С скорости двух реакций были равны. Как будут соотноситься скорости этих реакций, если температуру первой поднять на 60 0С, а второй на 40 0С. Температурные коэффициенты реакций равны: γ(1) = 2,5; γ(2) = 3.
Решение.
1. При 280 0С: v 1(t1) = v 2(t1)
2. При 340 0С: v 1(t2) = v 1(t1) · g  = v 1(t1) · 2,5
= v 1(t1) · 2,5  = v 1(t1) · 2,56.
= v 1(t1) · 2,56.
3. При 320 0С: v 2(t3) = v 2(t1) · g  = v 2(t1) · 3
= v 2(t1) · 3 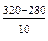 = v 2(t1) · 34.
= v 2(t1) · 34.
4.  ≈ 3.
≈ 3.
|
|
|


