 |
Комплексные соединения железа, кобальта и никеля
|
|
|
|
У элементов триады железа ярко проявляется способность d-элементов образовывать комплексные соединения.
Известны катионные аквакомплексы [Э(H2O)6]2+ и [Э(H2O)6]3+, аммиачные комплексы [Э(NH3)6]2+ и [Э(NH3)6]3+. Устойчивость аммиачных комплексов увеличивается в ряду Fe – Co – Ni. [Fe(NH3)6]2+ и [Co(NH3)6]2+ устойчивы только в твердой фазе и насыщенном водном растворе аммиака, аммиачный комплекс [Ni(NH3)6]2+ в водном растворе устойчив. Аммиачный комплекс железа (III) не устойчив, никеля (III) – не существует, а [Co(NH3)6]2+ – устойчив.
Многочисленны анионные комплексы элементов триады железа. Характерны галогенидные M+[Э2+Г3], M+2[Э2+Г4], M+3[Э2+Г6] и др., роданидные M+2[Э2+(CNS)4], M+4[Э2+(CNS)6], оксалатные M+2[Э2+(C2O4)2], M+3[Э3+(C2O4)3] комплексы. Особенно устойчивы цианидные комплексы, например: K3[Fe(CN)6] и K4[Fe(CN)6], которые используются в аналитической химии для обнаружения ионов Fe2+ и Fe3+.
Элементы триады железа образуют большое количество комплексных соединений с органическими лигандами, например: диметилглиоксимат никеля – реактив Чугаева и гемоглобин – внутрикомплексное соединение железа.
Соединения железа(II) и железа(III) –КО и ОВ характеристика,способность к комплексообразованию.Комплексные соединения железа(II) и железа(III) с цианид-и тиоционат-ионами.Гемоглабин и железосодержащие ферменты,химическая сущность их действия.
FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II): 
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
|
|
|
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой сини: 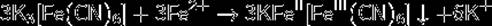
Для количественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9)[17].
Соединения железа (III)
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами: 
Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+ как правило окружен шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.
Ион Fe3+ полностью гидролизуется даже в кислой среде. При рН>4 этот ион практчиески полностью осаждается[18] в виде Fe(OH)3: 
При частичном гидролизе иона Fe3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.
Основные свойства гидроксида железа(III) Fe(OH)3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей: 
Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты:
Соединения железа(III) в растворах восстанавливаются металлическим железом: 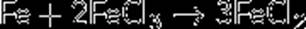
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами SCN−. При взаимодействии ионов Fe3+ с анионами SCN− образуется смесь ярко-красных роданидных комплексов железа [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]-.[19] Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим.
|
|
|
Другим качественным реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури: 
Комплексные соединения. Ионы Fe(II) и Fe(III) образуют комплексные анионы, например гексацианоферрат(II)-ион Fe(CN)64- и гексацианоферрат(III)-ион Fe(CN)63-. Берлинская лазурь (синий пигмент) - гексацианоферрат(II) железа(III) Fe4[[Fe(CN)6]]3, турнбулева синь (также синий пигмент) - гексацианоферрат(III) железа(II) Fe3[[Fe(CN)6]]2. Комплексные ионы железа часто используют для обнаружения ионов железа(II) и железа(III) по результатам образования окрашенных комплексных соединений. Они применяются также в светокопировальной технике (цианотипная бумага): бумагу пропитывают раствором соли железа(III) и высушивают. При наложении на нее чертежа, выполненного на кальке, и выдержке на свету Fe(III) восстанавливается на освещенных местах до Fe(II) и после проявления бумаги в растворе гексацианоферрата образует комплексное соединение, окрашивающее засвеченные места бумаги в синий цвет. Цианотипная бумага передает изображение белыми линиями на синем фоне.
Гемоглоби́н сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1].
Главная функция гемоглобина состоит в переносе кислорода. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее(почти в 500 раз), чем кислород, образуя карбоксигемоглобин (HbCO). Некоторые процессы приводят к окислению иона железа в геме до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от мета… и гемоглобин, иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода. Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в легких.
|
|
|
Метгемоглобин — производное гемоглобина, в котором железо окислено (трехвалентно). Метгемоглобин не способен переносить кислород. Образуется в организме при некоторых видах отравлений.[3]
Цитохромы (гемопротеины) — это маленькие глобулярные белки (в первом приближении их структура может быть представлена в виде шара или вытянутого эллипсоида), которые содержат ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками.
Цитохромы присутствуют во всех клетках организмов. В клетках эукариот они локализованы в митохондриальных мембранах. Цитохромы катализируют окислительно-восстановительные реакции.
|
|
|


