 |
Понятие о теории активированного комплекса (переходного состояния)
|
|
|
|
Теория основывается на квантовых представлениях о строении молекул и химической связи. Она должна решить следующие задачи:
1) рассмотреть энергетику взаимодействия реагирующих частиц с целью определения энергии активации;
2) рассчитать константы скорости химической реакции при известной энергии активации.
Рассмотрим бимолекулярную реакцию
AB + C → BC + A.
Считается, что частицы уже активированы, т.е. рассматриваем сам элементарный акт реакции, происходящий во времени.
При сближении активированных молекул взаимодействие между ними начинается еще до столкновения – старая связь ослабевает, но еще не разрушена, при этом одновременно образуется новая связь. Таким образом, образуется трехатомный конгломерат (активированный комплекс), который находится в равновесии с исходными веществами и затем распадается на продукты.

Активированный комплекс находится в равновесии с исходными веществами:

или, в более общем виде:

так что можно записать  . Активированный комплекс устойчив во всех направлениях, кроме пути реакции. Т.е. активированный комплекс может распасться только на продукты реакции.
. Активированный комплекс устойчив во всех направлениях, кроме пути реакции. Т.е. активированный комплекс может распасться только на продукты реакции.
Путь или координата реакции – это взаимосвязанное изменение совокупности межъядерных расстояний при переходе от начальной конфигурации атомов к конечной, сопровождающееся минимальным изменением потенциальной энергии. Сечение поверхности потенциальной энергии вдоль пути реакции называется профилем пути реакции (рис. 4).

Рис. 4. Энергетический профиль вдоль координаты реакции
Из хода кривой видно, что в процессе элементарного акта химического превращения система должна преодолеть потенциальный барьер, равный энергии активации. Истинная энергия активации  представляет собой разность энергий активированного комплекса и исходных молекул, отсчитанных от нулевого колебательного уровня. Ее обозначают
представляет собой разность энергий активированного комплекса и исходных молекул, отсчитанных от нулевого колебательного уровня. Ее обозначают  . Область состояния вблизи потенциального барьера можно рассматривать как переходное состояние. Для большинства элементарных реакций система, достигнувшая области переходного состояния, неизбежно перейдет в конечное состояние, т.е. перевалит через барьер.
. Область состояния вблизи потенциального барьера можно рассматривать как переходное состояние. Для большинства элементарных реакций система, достигнувшая области переходного состояния, неизбежно перейдет в конечное состояние, т.е. перевалит через барьер.
|
|
|
Для определения  необходимо построить поверхность потенциальной энергии U(q), т.е. знать зависимость потенциальной энергии от координаты реакции. Для этого необходимо решить уравнение Шредингера, что возможно только для простейших систем.
необходимо построить поверхность потенциальной энергии U(q), т.е. знать зависимость потенциальной энергии от координаты реакции. Для этого необходимо решить уравнение Шредингера, что возможно только для простейших систем.
Расчет константы скорости элементарной реакции при заданной энергии активации основан на постулатах:
1. Распределение молекул по энергиям и скоростям подчиняется распределению Максвелла-Больцмана. Превращение активных комплексов в продукты реакции не нарушает этого распределения, т.е. доля активных частиц в ходе реакции не изменяется, и поэтому концентрацию активных комплексов можно вычислить из распределения Максвелла-Больцмана.
2. Реакция протекает адиабатически. Адиабатическое приближение состоит в том, что система взаимодействующих атомов делится на две подсистемы – медленную подсистему ядер и быструю подсистему электронов, которая успевает быстро, безынерционно перестроиться при изменении конфигурации ядер. Поэтому можно рассматривать только одну поверхность потенциальной энергии для ядер, которые и должны преодолеть энергетический барьер в ходе реакции.
3. Активированный комплекс находится в равновесии с исходными веществами
 .
.
Скорость реакции определяется лимитирующей стадией – распадом активированного комплекса. Её можно определить либо по закону действующих масс
 ,
,
либо как число активных комплексов, прореагировавших в единицу времени  ,
,
|
|
|
где  - концентрация активированных комплексов, а τ – время жизни активированного комплекса.
- концентрация активированных комплексов, а τ – время жизни активированного комплекса.
. 
Активированный комплекс существует не при определенном значении межъядерных расстояний, а в каком-то интервале δ, следовательно, время жизни комплекса
 ,
,
где  - средняя скорость движения активированного комплекса через вершину энергетического барьера (одномерная скорость).
- средняя скорость движения активированного комплекса через вершину энергетического барьера (одномерная скорость).
Используя приведенные выражения для средней скорости движения активного комплекса и аппарат статистической термодинамики, получаем следующее выражение для константы скорости:
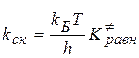 ,
,
где  - постоянная Больцмана,
- постоянная Больцмана,
h – постоянная Планка
 - константа равновесия активированного комплекса, которая равна
- константа равновесия активированного комплекса, которая равна  .
.
В тех случаях, когда адиабатическое приближение не выполняется, и электронная подсистема преодолевает свой энергетический барьер, в выражение для kск вносят трансмиссионный множитель  , он меньше единицы:
, он меньше единицы:
 .
.
Физический смысл трансмиссионного коэффициента состоит в том, что не всегда образованный активированный комплекс разваливается с образованием продуктов реакции, существует вероятность образования из него исходных веществ. При χ=1 эффективность развала АК в продукты составляет 100%.
При термодинамическом подходе константу равновесия выражают через разность термодинамических функций активированного комплекса и исходных веществ.
Для бимолекулярной реакции в растворе константу равновесия выражают через функцию Гельмгольца образования активированного комплекса:
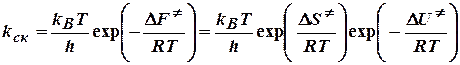 .
.
Для бимолекулярной реакции в газовой фазе в формулу добавляется множитель RT/p0, необходимый для перехода от  к
к  :
:
 .
.
Энтропийный множитель иногда интерпретируют как стерический фактор Р из теории активных соударений.
Серьезным недостатком теории переходного состояния является отсутствие экспериментальных данных о строении активированного комплекса, что затрудняет ее применение. Несмотря на это, благодаря сравнительной простоте математического аппарата она является наиболее широко используемой теорией кинетики элементарных химических реакций, позволяет правильно объяснить и полуколичественно предсказать много закономерностей для кинетики химических реакций.
|
|
|
Катализ
Явление катализа – это изменение скорости реакции под действием некоторых веществ, которые к концу реакции остаются в химически неизменном виде.
Разновидности катализа:
1) положительный – под действием некоторых веществ скорость реакции увеличивается;
2) отрицательный: под действием некоторых веществ скорость реакции уменьшается, такие вещества называются ингибиторами;
3) автокатализ: катализатором являются продукты реакции;
4) гомогенный: катализатор и реагенты находятся в одной фазе (газ или раствор);
5) гетерогенный: катализатор и реагенты находятся в разных фазах;
6) ферментативный: катализатором является биологический фермент.
Принципы катализа:
1) катализатор принимает участие в химической реакции, образуя промежуточные продукты, но в конце реакции выделяется в химически неизменном виде. Физическое состояние катализатора, входящего в активный комплекс, может существенно изменяться, например, уменьшатся размеры зерен твердого катализатора, изменится структура поверхностных слоев;
2) катализатор не смещает положение равновесия, а лишь увеличивает скорость прямой и обратной реакции в равной степени;
3) действие катализатора является специфичным (селективным);
4) катализатор увеличивает скорость реакции за счет уменьшения Еакт, ведет реакцию по пути с меньшим энергетическим барьером.
Гомогенный катализ
Рассмотрим схему реакции, протекающей без катализатора:
A + B → AB* →C + D.
В присутствии катализатора реакция протекает в несколько стадий:
1. 
2. 
3. 
При условии k3>>k1 скорость образования продуктов можно выразить через концентрации реагентов и катализатора:

Это уравнение лежит в основе кинетики гомогенных каталитических реакций. Из уравнения видно, что скорость процесса прямо пропорциональна концентрации катализатора, исключение составляют лишь случаи, когда катализатор находится в большом избытке, в результате чего скорость процесса лимитируется не кинетическими, а физическими закономерностями, например, диффузией растворенного вещества к катализатору.
|
|
|
Энергетический профиль каталитической реакции представлен на рисунке 4.

Рис.4. Энергетические профили
реакций с катализатором и без него.
Е1 – энергия активации некаталитической реакции,
Е2 – каталитической реакции
В ранних исследованиях предполагалось, что поверхность катализатора энергетически однородна (Лэнгмюр). В дальнейшем была экспериментально доказана адсорбционная неоднородность поверхности. Возникло представление о том, что каталитически активны только определенные участки поверхности, на которых имеются адсорбционные центры. Здесь вещество способно образовать активное для протекания данного каталитического процесса промежуточное поверхностное соединения, благодаря чему понижается энергия активации реакции.
Гетерогенный катализ
В случае гетерогенного катализа реакции происходят на границе раздела фаз.
Гетерогенный катализ состоит из следующих стадий:
1. массоперенос реагентов к катализатору;
2. абсорбция – образование абсорбированного комплекса между реагентом и катализатором;
3. каталитическая реакция – образование продукта в основном адсорбированном состоянии;
4. десорбция продукта;
5. внутренний массоперенос (изнутри катализатора);
6. внешний массоперенос (из области реакции).
Общая скорость каталитической реакции определяется скоростью самой медленной из этих стадий. Если не рассматривать диффузию и считать, что равновесие «адсорбция ↔ десорбция» устанавливается быстро, то скорость каталитической реакции определяется скоростью реакции в адсорбционном слое, где роль реагента играют свободные адсорбционные центры. Простейший механизм гетерогенного катализа описывается схемой:
 .
.
Для придания катализаторам большей избирательности, термической стойкости, механической прочности и активности их часто применяют в форме многокомпонентных систем: смешанных, на носителях, промотированных катализаторов.
Промоторы - это вещества, которые не обладают каталитическими свойствами, но добавление их к катализатору значительно увеличивает его активность.
Каталитические яды - это вещества, понижающие активность катализатора.
Активность катализаторов оценивают либо количеством вещества (в молях), реагирующих в единицу времени под воздействием единицы массы катализатора, или количеством вещества (в молях), реагирующих в единицу времени под воздействием единицы поверхности катализатора.
Ферментативный катализ
Ферментативными реакциями называются такие химические процессы в биологических системах, скорость которых регулируется веществами биологического происхождения. Это белковые молекулы, называемые ферментами или энзимами.
|
|
|
Ферментативный катализ играет огромную роль в жизнедеятельности организма. Широкое применение получили ферментные препараты при нарушениях функции желудочно-кишечного тракта, связанных с недостаточной выработкой пищеварительных ферментов (пепсин, панкреатин). При ожогах, гнойных ранах, гнойно-воспалительных заболеваниях легких, когда необходимо разрушить накопившиеся в большом количестве белковые образования, применяются протолитические ферменты, приводящие к быстрому гидролизу белков и способствующие рассасыванию гнойных скоплений. Для лечения инфекционных заболеваний используются препараты лизоцина, которые разрушают оболочку некоторых болезнетворных бактерий. Очень важные ферменты, которые рассасывают тромбы (сгустки крови внутри кровеносных сосудов) – плазмин, трипсин, химотрипсин, на их основе с разными добавками созданы различные лекарственные препараты – стрептокиназа, стрептаза, и т.п., широко применяемые в медицине.
Выделения ферментов в особый класс катализаторов обусловлен особыми свойствами этих веществ:
1) высокая специфичность;
2) эффективность действия;
3) биологические катализаторы образуются и разрушаются в процессе
жизнедеятельности организма.
По своей каталитической активности биологические катализаторы в тысячи раз превышают неорганические. Специфичность действия связана с особенностями структуры фермента и субстрата. Одни части каталитической системы выполняют функции, главным образом связанные с пространственной организацией системы, другие в этой организационной системе осуществляют собственно катализ. Т.е., как и при неферментативном катализе, в каталитической реакции участвует не вся белковая молекула в целом, а лишь определенные ее участки – активные центры фермента.
Простейшая схема ферментативного катализа включает обратимое образование промежуточного комплекса фермента (Е) с реагирующим веществом (субстратом S) и разрушение этого комплекса с образованием продуктов реакции (Р):
 .
.
При условии, что k3>>k1, с учетом уравнения материального баланса [E]=[E0]-[ES] (индекс «0» означает начальную концентрацию) получаем уравнение Михаэлиса-Ментен. В уравнении скорость образования продукта выражена через начальную концентрацию фермента и текущую концентрацию субстрата:
 ,
,
где w max=k2[E0] – максимальная скорость реакции;
 - это константа Михаэлиса.
- это константа Михаэлиса.
|
|
|


