 |
Строение и номенклатура органических соединений.
|
|
|
|
1. Строение органических соединений.
2. Номенклатура органических соединений.
1.Как уже было сказано выше, наиболее характерной для органических соединений является ковалентная связь. Она образуется за счет общих электронных пар между связываемыми атомами. Образование ковалентной связи выгодно обоим атомам (они приобретают завершенный электронный слой), поэтому связь образуется прочная. Группа атомов, соединенных ковалентными связями, называется молекулой. Органические соединения обычно имеют молекулярное строение. Ковалентная связь обычно образуется за счет обобществления неспаренных электронов двух атомов. Но некоторые атомы (азот, кислород, сера) для образования связей используют не все свои валентные электроны. Неподеленные пары электронов могут участвовать в образовании ковалентной связи по донорно-акцепторному механизму.Кроме того, такой атом, с неподеленной парой электронов, может взаимодействовать с атомом с пониженной электронной плотностью (δ+) из другой молекулы или другой части большой органической молекулы. Чаще всего таким атомом является водород. В результате такого взаимодействия возникает водородная связь, которую графически обозначают обычно тремя точками. Энергия водородной связи невелика (1—40 кДж/моль) и в основном определяется электростатическим взаимодействием. Водородные связи способствует стабилизации формы сложных органических молекул (белки) или ассоциации небольших молекул в димеры или более сложные образования (спирты и карбоновые кислоты).
Хорошо известно, что атом углерода обычно четырехвалентен. Это объясняют тем, что при образовании соединения атом углерода переходит в «возбужденное состояние» и один из двух s- электронов переходит на свободную р-орбиталь. Таким образом атом получает четыре неспаренных электрона и может образовать четыре ковалентные связи. Для обоснования равноценности этих связей используют понятие гибридизации орбиталей. Гибридизация электронных орбиталей – это выравнивание их по размерам и форме, а значит и по энергии. (Гибридизацию следует понимать, как математическую модель, а не некий физический процесс.) В зависимости от числа орбиталей, принимающих участие в гибридизации различают три вида: sp3, sp2 и sp-гибридизацию.
|
|
|
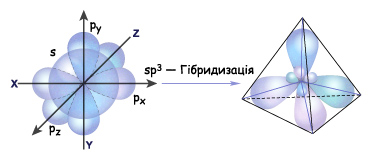 Рассмотрим первую из них - sp3 – гибридизацию.
Рассмотрим первую из них - sp3 – гибридизацию.
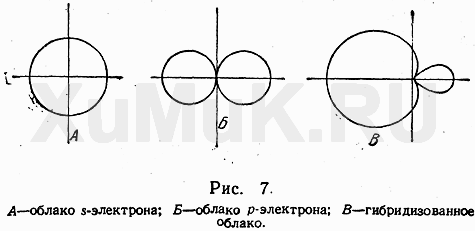
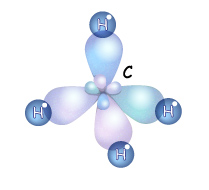
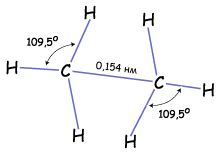 Итак, если гибридизации подвергаются четыре разных орбитали, то и образуется четыре. Но это уже одинаковые орбитали (гибридные). Форма гибридной орбитали – неправильная объемна восьмерка. Орбитали максимально удалены друг от друга (электронные облака заряжены отрицательно и отталкиваются друг от друга), и поэтому их вершины направлены к вершинам тетраэдра. Угол между связями примерно1090. Если атом углерода находится в состоянии sp3 – гибридизации, то все четыре гибридные орбитали могут перекрываться с гибридными и негибридными орбиталями других атомов на прямой, связывающей центры
Итак, если гибридизации подвергаются четыре разных орбитали, то и образуется четыре. Но это уже одинаковые орбитали (гибридные). Форма гибридной орбитали – неправильная объемна восьмерка. Орбитали максимально удалены друг от друга (электронные облака заряжены отрицательно и отталкиваются друг от друга), и поэтому их вершины направлены к вершинам тетраэдра. Угол между связями примерно1090. Если атом углерода находится в состоянии sp3 – гибридизации, то все четыре гибридные орбитали могут перекрываться с гибридными и негибридными орбиталями других атомов на прямой, связывающей центры  атомов и образуют прочные
атомов и образуют прочные  -связи (сигма-связи). в молекулах углеводородов.
-связи (сигма-связи). в молекулах углеводородов.  -связь – это прочная ковалентная связь, образованная за счет перекрывания электронных орбиталей на прямой соединяющей центры атомов.
-связь – это прочная ковалентная связь, образованная за счет перекрывания электронных орбиталей на прямой соединяющей центры атомов.
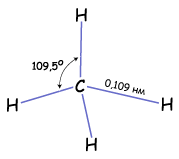
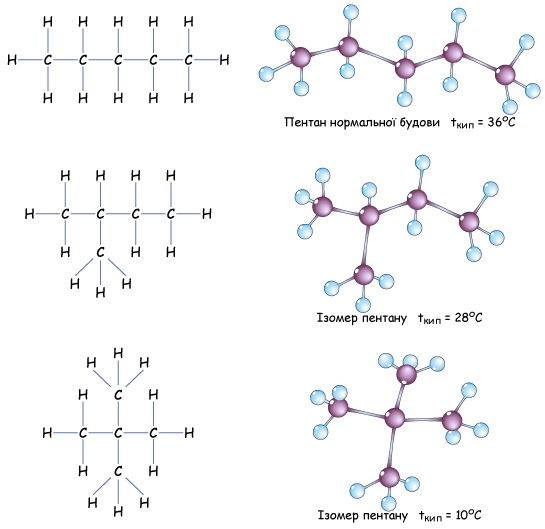 Т.е. если атом углерода образует четыре связи с четырьмя разными атомами, то он находится в состоянии sp3-гибридизации, и угол между ними 1090. Этот тип гибридизации является самым распространенным в органических соединениях. Это означает что молекулы органических соединений не имеют линейного строения, а зигзагообразно изогнуты в пространстве. А так как вокруг одинарных связей возможно свободное вращение без разрыва этой связи, то форма органической молекулы в пространстве может меняться. Но на бумаге мы изображаем строение молекулы условно, и четыре одинарные связи углерода рисуем в структурной формуле под углом 90о. Каждая σ-связь в структурной формуле изображается черточкой. А в электронной формуле молекулы двумя точками - парой электронов.
Т.е. если атом углерода образует четыре связи с четырьмя разными атомами, то он находится в состоянии sp3-гибридизации, и угол между ними 1090. Этот тип гибридизации является самым распространенным в органических соединениях. Это означает что молекулы органических соединений не имеют линейного строения, а зигзагообразно изогнуты в пространстве. А так как вокруг одинарных связей возможно свободное вращение без разрыва этой связи, то форма органической молекулы в пространстве может меняться. Но на бумаге мы изображаем строение молекулы условно, и четыре одинарные связи углерода рисуем в структурной формуле под углом 90о. Каждая σ-связь в структурной формуле изображается черточкой. А в электронной формуле молекулы двумя точками - парой электронов.
|
|
|
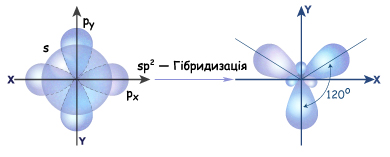
Если атом углерода находится в состоянии sp2-гибридизации, значит смешиваются одна s -орбиталь и две р-орбитали и образуются три гибридные sp2-орбитали. Они очень похожи на sp3-орбитали, но немного короче (меньше вклад р-орбиталей). Все три гибридные орбитали лежат в одной плоскости и максимально удалены друг от друга (т.е. находятся под углом 1200). Одна из р-орбиталей сохраняет форму правильной объемной восьмерки и располагается перпендикулярно плоскости, в которой лежат гибридные орбитали. При сближении двух атомов, которые находятся в sp2гибридном состоянии, перекрываются их гибридные орбитали на прямой, которая соединяет центры этих атомов. Т.е. образуется  -связь.
-связь.
Например,  -связь в молекуле этена образована за счет перекрывания гибридных электронных орбиталей на прямой соединяющей центры атомов (С-С и С-Н).
-связь в молекуле этена образована за счет перекрывания гибридных электронных орбиталей на прямой соединяющей центры атомов (С-С и С-Н).
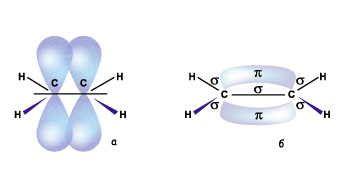
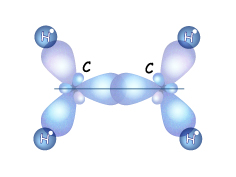
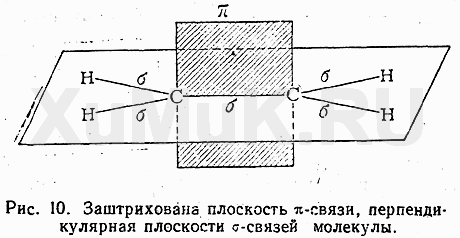
 Но при сближении атомов происходит перекрывание и двух негибридных р-орбиталей, расположенных параллельно друг другу. Область перекрывания лежит над и под плоскостью, в которой находятся
Но при сближении атомов происходит перекрывание и двух негибридных р-орбиталей, расположенных параллельно друг другу. Область перекрывания лежит над и под плоскостью, в которой находятся  -связи этих атомов. Так между двумяsp2 –гибридными атомами образуется дополнительная связь, которую называют
-связи этих атомов. Так между двумяsp2 –гибридными атомами образуется дополнительная связь, которую называют  -связью.Такое боковое перекрывание оказывается менее эффективно, чем осевое, и значит связь менее прочной.Итак,
-связью.Такое боковое перекрывание оказывается менее эффективно, чем осевое, и значит связь менее прочной.Итак,  -связь образована за счет перекрывания негибридных р-орбиталей вне прямой соединяющей центры атомов, перпендикулярно плоскости в которой лежат
-связь образована за счет перекрывания негибридных р-орбиталей вне прямой соединяющей центры атомов, перпендикулярно плоскости в которой лежат  связи. Комбинацию из одной
связи. Комбинацию из одной  -связи и одной
-связи и одной  -связи называют двойной связью и обозначают двумя черточками.
-связи называют двойной связью и обозначают двумя черточками.
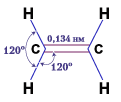
 Структурную формулу этена записывают обычно СН2=СН2.
Структурную формулу этена записывают обычно СН2=СН2.
Аналогичное строение имеет двойная связь между атомами С= О и С=N, только она полярна. Надо помнить, что несмотря на то что в структурной формуле мы рисует одинаковые черточки, это две разные связи.  -связь более прочная, а
-связь более прочная, а  -связь намного слабее и легко разрывается. Двойные связи характерны для углеводородов (алкены и алкадиены) и для карбонильных соединений (альдегидов, кетонов).
-связь намного слабее и легко разрывается. Двойные связи характерны для углеводородов (алкены и алкадиены) и для карбонильных соединений (альдегидов, кетонов).
|
|
|
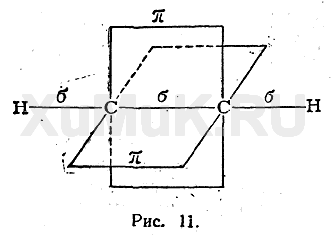
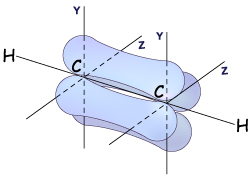
Гораздо реже встречается третий тип гибридизации углерода, в котором участвуют одна s-орбиталь и одна р-орбиталь. Две равноценные гибридные орбитали расположены на одной прямой и направлены в противоположные стороны (угол между ними – 180о). Большая доля у них еще более укорочена (вклад р-орбитали еще меньше). Они образуют в результате перекрывания с другими орбиталями на прямой, соединяющей центры атомов,  -связи. Две негибридные р-орбитали направлены перпендикулярно оси, на которой расположены
-связи. Две негибридные р-орбитали направлены перпендикулярно оси, на которой расположены  -связи, и за счет бокового перекрывания образуют две
-связи, и за счет бокового перекрывания образуют две  -связи. В итоге образуется т.н. «тройная связь».
-связи. В итоге образуется т.н. «тройная связь».
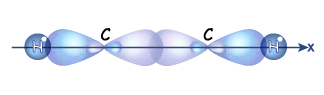
Надо помнить, что несмотря на то что в структурной формуле мы рисует одинаковые черточки, это связи разные, одна прочная  -связь и две
-связь и две  -связи, которые легко разрываются.
-связи, которые легко разрываются.
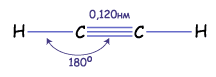
Химическая связь характеризуется длиной, энергией и полярностью. Длина связи зависит от размера атомов, между которыми возникает. Дополнительное  связывание приводит к уменьшению расстояния между ядрами, поэтому тройная связь короче двойной, а двойная короче одинарной. Энергия связи – это энергия, которая выделяется при ее образовании или необходима для ее разрыва. Энергия двойной связи (620 кДж/моль) меньше удвоенного значения энергии одинарной связи (350 кДж/моль). А это значит, что энергия
связывание приводит к уменьшению расстояния между ядрами, поэтому тройная связь короче двойной, а двойная короче одинарной. Энергия связи – это энергия, которая выделяется при ее образовании или необходима для ее разрыва. Энергия двойной связи (620 кДж/моль) меньше удвоенного значения энергии одинарной связи (350 кДж/моль). А это значит, что энергия  -связи меньше, чем у
-связи меньше, чем у  -связи. Полярность связи характеризует неравномерность распределения электронной плотности между атомами с различной ЭО. Появление зарядов на атомах (даже частичных!) очень сильно изменяет реакционную способность вещества.
-связи. Полярность связи характеризует неравномерность распределения электронной плотности между атомами с различной ЭО. Появление зарядов на атомах (даже частичных!) очень сильно изменяет реакционную способность вещества.
2.Номенклатура является «химическим языком», служащим для передачи информации о строении соединений, а значит и о их свойствах. Существует несколько разных номенклатур органических соединений, но мы должны научиться пользоваться систематической заместительной номенклатурой ИЮПАК (Международный союз теоретической и прикладной химии). Названия иногда бывают очень громоздкими, поэтому для краткости в систематической номенклатуре допускается употребление некоторых тривиальных (обыкновенных) названий, оговоренных в правилах ИЮПАК.
|
|
|
|
|
|


