 |
Диаграмма состояния сплавов железа с углеродом
|
|
|
|
I. ЦЕЛЬ РАБОТЫ
Изучить фазовые и структурные превращения по диаграмме Fe – Fe 3 C в равновесном состоянии.
II. ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Диаграмма состояния – графическое изображение состояния сплава изучаемой системы в зависимости от его концентрации и температуры. Диаграмма состояния показывает равновесные, устойчивые состояния, т.е. такие, которые при данных условиях обладают минимальной свободной энергией.
Исследование любого сплава начинается с построения и анализа диаграммы состояния соответствующей системы, так как диаграмма состояния дает возможность изучать фазы и структурные составляющие сплава.
Пользуясь диаграммой состояния, можно установить возможность проведения термической обработки, термического упрочнения и параметры их режима, температурные режимы литья и пластической деформации.
Сплавы железа с углеродом (стали и чугуны) являются наиболее распространенными металлическими материалами и составляют примерно 95% от всех применяемых металлических материалов. Сталь – основа современной техники. Чугун наиболее распространенный литейный сплав и основной исходный материал для выплавки стали. Техническое железо – с минимальным содержанием углерода и других примесей – производят в небольших количествах для нужд электротехники.
Первое представление о диаграмме состояния железо-углерод дал русский металлург Д.К. Чернов, который в 1868 году указал на существование в стали критических точек, их зависимость от содержания в ней углерода и впервые указал на полиморфизм железа.
Диаграмма состояния сплавов Fe – Fe 3 C охватывает не все сплавы от 0 до 100% углерода, а только часть их с содержанием углерода от 0 до 6,67% или с содержанием цементита Fe 3 C от 0 до 100%. Железоуглеродистые сплавы с более высоким содержанием углерода практического применения не имеют, так как они очень хрупкие.
|
|
|
4
Диаграмма состояния Fe – Fe 3 C по сравнению с основными типами диаграмм состояния двойных сплавов является более сложной.
Основными элементами, от которых зависят структура и свойства сталей и чугунов, являются железо и углерод.
ЧИСТОЕ ЖЕЛЕЗО – серебристо-светлый металл, атомный номер26, атомный вес 55,85. Технически чистое железо содержит 0,10...0,15% всех примесей. Наиболее чистое железо, полученное в лабораторных условиях, содержало 99,9917% Fe. Свойства железа зависят от степени его чистоты. Для технически чистого железа температура плавления равна 1539°С ± 5 °С, плотность 7,85 г/см3. Железо обладает невысокой твердостью и прочностью HB ~ 80; σВ ≈ 250 МПа; σ0,2 ≈ 120 МПа и хорошей пластичностью δ ≈ 50 %; ψ ≈ 80 %.
При нагреве железо испытывает аллотропические превращения. До 911°С железо имеет кубическую объемноцентрированную решетку (ОЦК) (К8), его обозначают Feα. При 911°С происходит превращение кубической объемноцентрированной решетки в кубическую гранецентрированную решетку (К12), в температурном интервале 911... 1392°С железо обозначают Feγ. При 1392°С вновь происходит перестройка г.ц.к. решетки в о.ц.к., которую обозначают Feα или Feδ; она сохраняется до температуры плавления. При 768°С на кривой нагрева железа появляется перегиб, соответствующий изменению магнитный свойств железа (точка Кюри для железа). До 768°С Feα ферромагнитно, выше 768°С Feα парамагнитно. Пока не было установлено, что магнитные превращения не связаны с аллотропией, немагнитное Feα обозначали как модификацию Feβ, существовавшую от 768 до 911°С.
УГЛЕРОД в природе встречается в виде двух модификаций в форме алмаза, имеющего сложную кубическую решетку, и в форме графита, имеющего простую гексагональную решетку. Плотность графита 2,25 г/см3. В отличие от других материалов прочность графита увеличивается при повышении температуры: при 20°С σВ ≈ 20 МПа;: при 2500°С σВ ≈ 40 МПа; что выше прочности всех тугоплавких металлов при данной температуре. При нагреве до 3650°С сублимация (возгонка) графита – превращение в газообразное состояние, минуя жидкое состояние.
|
|
|
В результате взаимодействия железа с углеродом образуются следующие четыре фазы.
5
ФЕРРИТ (Ф) – твердый раствор внедрения углерода в Feα. Обозначается Feα(С). Растворимость углерода в Feα очень низкая. Максимальная растворимость достигает 0,02% при 727°С. При комнатной температуре растворяется меньше 0,006% углерода.
Поры в решетке Feα гораздо меньше размеров атома углерода (диаметр атома углерода 0,154 нм), по-видимому углерод находится в дефектах решетки. Название фазы «феррит» связано с ее феррамагнитными свойствами. Выше 1392°С высокотемпературный δ –феррит [ Feδ (C)] имеет предельную растворимость углерода 0,1% при 1499°С. Твердость и механические свойства феррита близки к свойствам технически чистого железа; они зависят от количества легирующих элементов, присутствующих в нем (многие металлы и неметаллы образуют с ферритом твердые растворы замещения). Феррит Feα (C) с 0,006% С при температуре 20°С имеет σВ ≈ 250 МПа; σ0,2 ≈ 120 МПа; δ ≈ 50 %; ψ ≈ 80 % HB 80... 90 (800... 900 МПа), т.е. феррит мягок и пластичен.
АУСТЕНИТ (А) – твердый раствор внедрения углерода в Feγ. Его обозначают Feγ(С). Фаза имеет название в честь английского ученого Р.Аустена. Углерод занимает пору в центре г.ц.к. ячейки. Максимальная растворимость углерода в Feγ 2,14% при 1147°С, а при 727°С – всего лишь 0,8%. Аустенит – парамагнитен, вязок, весьма пластичен (δ = 40... 50%), имеет низкую прочность и твердость, НВ ~ 170... 220 (1700... 2200 МПа). Легирующие элементы растворяющиеся в аустените могут значительно изменить его свойства, а также температурные границы его существования.
ЦЕМЕНТИТ (Ц) – химическое соединение железа с углеродом (Fe 3 C – карбид железа), образующееся при содержании углерода 6,67% (цементит имеет сложную орторомбическую решетку, в элементарной ячейке которой находятся 12 атомов железа и 4 атома углерода). Температура плавления цементита 1250°С. Цементит имеет очень высокую твердость (НВ – 800 (8000 МПа), хрупкий. До 217°С обладает слабыми феррамагнитными свойствами. По условиям образования различают цементит первичный (ЦI), вторичный (ЦII), третичный (ЦIII).
|
|
|
ЖИДКИЙ РАСТВОР (ЖР) – хорошо перемешанные атомы железа и углерода. Жидкое железо хорошо растворяет углерод, образуя однородную жидкую фазу с неограниченной растворимостью компонентов.
6
Из этих фаз при определенной температуре и концентрации углерода могут образоваться двухфазовые структуры.
ПЕРЛИТ (П) – это механическая или эвтектоидная смесь феррита и цементита вторичного. Образуется при охлаждении из аустенита с содержанием углерода 0,8% от 727°С. Название перлит эвтектоид получил за блеск на полированном и протравленном шлифе, напоминающий блеск перламутра. Твердость пластинчатого перлита НВ 200... 250 (2000... 2500 МПа) а зернистого перлита 160... 220 (1600... 2200 МПа).
ЛЕДЕБУРИТ (Л) – это механическая или эвтектическая смесь аустенита и цементита первичного. Ледебурит образуется при охлаждении из жидкого раствора с содержанием углерода 4,3% от 1147°С. При дальнейшем охлаждении ниже 727°С аустенит, входящий в ледебурит, превращается в перлит. Эвтектика названа в честь немецкого ученого Ледебура. Ледебурит отличается большой твердостью (НВ 600... 700 или 6000... 7000 МПа) и хрупкостью.
На диаграмме Fe – Fe 3 C можно выделить две области по содержанию углерода: стали – с содержанием углерода от 0 до 2,14% и чугуны – с содержанием углерода от 2,14 до 6,67% (рис. 1).
Рассмотрим фазовые превращения при охлаждении сплавов с различным содержанием углерода (см. рис. 1). Для упрощения допускаем, что фазовые превращения начинаются на соответствующих линиях, в действительности происходят ниже, так как запас свободной энергии новой и старой фаз на соответствующих линиях одинаков. Однако чтобы происходило фазовое превращение, необходим меньший запас свободной энергии новой фазы, чем старой, что достигается переохлаждением сплава ниже соответствующей линии. Метастабильную диаграмму состояния Fe – Fe 3 C рассматриваем от высоких температур расплавленного раствора до комнатной (20°С).
|
|
|
Линия ABCD – линия ликвидус, от которой начинается процесс кристаллизации и выше которой сплавы находятся в жидком состоянии. Линия AHJECF – линия солидус, на которой заканчивается процесс кристаллизации. Ниже линии солидус все сплавы находятся в твердом состоянии.
В сплавах, содержащих до 0,1% углерода (до точки Н, см. рис. 1), при охлаждении происходит кристаллизация Feδ (C) с последующим превращением его в аустенит. В сплавах, содержащих 0,1... 0,5% углерода (до точки В, см. рис. 1), образование аустенита происходит по линии HJB при 1499°С.
7
Таким образом все сплавы, содержащие до 2,14% углерода, после окончания кристаллизации жидкого раствора имеют структуру аустенита.
Сплавы, с содержанием углерода меньше 0,02%, расположены левее точки P и представляют собой технически чистое железо. После кристаллизации аустенита при его охлаждении до точки на линии GS в сплаве никаких фазовых превращений не происходит: аустенит просто охлаждается. На линии GS начинается перестройка решетки аустенита (г.ц.к.) в решетку феррита (о.ц.к.) с изменением содержания углерода в обоих твердых растворах: по мере охлаждения состав аустенита изменяется по линии GS, а состав феррита – по линии GP. Состав сплавов и количество фаз для сплавов системы Fe – Fe 3 C определяют и рассчитывают по правилу отрезков. В точке А 1 на линии GP вторичное превращение заканчивается и до точки на линии PQ происходит охлаждение образовавшегося феррита. Ниже линии OP сплавы находятся в области двухфазного состояния Ф+Ц. Линия PQ (см. рис. 1) – линия переменной растворимости углерода в решетке феррита от 0,02 до 0,006%. Этот избыточный углерод образует с железом химическое соединение Fe 3 C, т.е. ЦIII (цементит третичный, в отличие от цементита вторичного ЦII). При обычном охлаждении ЦIII выделяется главным образом внутри зерен в виде очень дисперсных включений, увеличивая прочность феррита. Если охлаждение проводить медленно, то ЦIII будет выделяться по границам зерен феррита.
Рассмотрим первичные и вторичные превращения в сталях, т.е. в сплавах с содержанием углерода от 0,02 до 2,14%.
Углеродистыми сталями называют сплавы железа с углеродом (содержание углерода до 2,14%, точка Е, рис.1), заканчивающие кристаллизацию образованием аустенита. В структуре таких сплавов отсутствует эвтектика (ледебурит), благодаря чему они обладают высокой пластичностью, особенно в аустенитном состоянии.
По структуре углеродистые стали подразделяют на доэвтектоидные, эвтектоидные и заэвтектоидные.
Кривая охлаждения сплава I (см. рис. 1) типична для всех сплавов, содержащих от 0,02 до 0,8% углерода, разница – только в температурах критических точек. От точки 0 до точки 1 (рис. 2, а) никаких превращений в жидком растворе не происходит. В точке на линии ВС (см. рис. 1 и рис. 2, а) начинается кристаллизация аустенита и в точке на линии JE заканчивается. При этом состав жидкой фазы изменяется по линии ликвидуса BC, а состав аустенита – по линии солидус JE.
|
|
|
   |
10
Выше точки Ac 3 на линии GS доэвтектоидная сталь имеет структуру аустенита. Ниже точки Ar 3 на линии GS в доэвтектоидных сталях начинаются вторичные превращения, т.е. превращения в твердом состоянии (см. рис. 1 и рис. 2, в). При медленном охлаждении Ar 3 начинается распад аустенита с выделением феррита, который протекает до точки Ar 1 на линии PSK.
Вследствие выделения из аустенита феррита концентрация углерода в аустените непрерывно возрастает (между точками Ar 3 и Ar 1) и при достижении точки Ar 1 концентрация углерода в аустените становится равной 0,8%, т.е. эвтектоидной состав аустенита изменяется по линии GS, состав феррита по линии GP (см. рис. 1). В точке Ar 1 при 727°С происходит второй этап – эвтектоидно-перлитный распад аустенита с концентрацией углерода 0,8%, т.е. 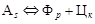 . Чем больше в стали углерода, т.е. чем ближе располагается сплав к точке S, тем большее время необходимо для этого превращения и в структуре сплава будет больше перлита. Структура стали ниже точки Ar 1 будет состоять из Ф+П.
. Чем больше в стали углерода, т.е. чем ближе располагается сплав к точке S, тем большее время необходимо для этого превращения и в структуре сплава будет больше перлита. Структура стали ниже точки Ar 1 будет состоять из Ф+П.
Сплав II (см. рис. 1 и рис. 2, б) содержит 0,8% углерода, т.е. по составу отвечает точке эвтектоидного превращения. При его охлаждении до 727°С аустенит не испытывает никаких превращений, поэтому при температуре 727°С весь аустенит превратится в перлит по эвтектоидной реакции
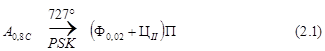
При эвтектоидном превращении наблюдается восходящая диффузия. Ведущей фазой является цементит. Пластинка цементита начинает расти от границы зерна аустенита, центром кристаллизации оказывается неметаллическое включение. Соседние области обедняются углеродом и там образуется феррит, причем г.ц.к. решетка аустенита превращается в о.ц.к. решетку феррита. Повторяясь многократно, этот процесс приводит к образованию зерна перлита, состоящего из параллельных пластинок, цементита и феррита. Чем грубее и крупнее выделение цементита, тем хуже механические свойства перлита.
Сплав III (см. рис. 1 и рис. 2, г) содержит углерода больше 0,8%, но меньше 2,14%, т.е. он располагается между точками S и E. После кристаллизации заэвтектоидная сталь, как и доэвтектоидная и
11
эвтектоидная стали, имеет структуру аустенит, т.е. кристаллизация сплава III протекает также, как и сплавов I и II.
Аустенит заэвтектоидной стали содержит большее количество углерода по сравнению с эвтектоидной сталью, поэтому распад аустенита начинается с выделения фазы, богатой углерожом, т.е. цементита вторичного при температурах по линии ES. Точка Е соответствует максимальной растворимости углерода в аустените, т.е. 2,14%, а точка S – минимальной, т.е. 0,8%. Избыточный углерод по мере понижения температуры выделяется из решетки аустенита и образует с железом вторичный цементит ЦII.
В точке Ar 1 при 727°С происходит эвтектоидное превращение по реакции (2.1). Таким образом, после окончательного охлаждения сплав будет иметь структуру П+ЦII. По сравнению с ЦIII выделение ЦII происходит при более высоких температурах, когда скорости диффузии велики. Поэтому ЦII образуется по границам зерен в виде сетки. Цементит первичный, вторичный, третичный по химическим и физическим свойствам не отличаются, так как все они – карбид железа Fe 3 C, отличие только в условиях образования, что влияет на размер и форму зерна цементита. При первичной кристаллизации из жидкого раствора образуется цементит первичный (ЦI), при вторичной кристаллизации из твердого раствора аустенита образуется цементит вторичный (ЦII), а при третичный превращениях из твердого раствора феррита выделяется цементит третичный (ЦIII).
Особенностью всех сплавов с содержанием углерода от 2,14 до 6,67% является наличие в их структуре ледебурита (Л). Это чугун.
Белые чугуны делятся на доэвтектический (содержание углерода от 2,14 до 4,3%), эвтектический (содержание углерода 4,3%) и заэвтектический (содержание углерода от 4,3 до 6,67%) (см. рис. 1).
Кривая охлаждения сплава V доэвтектического белого чугуна типична для всех сплавов, содержащих от 2,14 до 4,3% С, т.е. расположенных от точки Е до точки С. Кристаллизация зерен аустенита начинается в точке 1 и заканчивается в точке 2 (см. рис. 1 и рис. 3, б). С понижением температуры состав аустенита изменяется по линии солидуса JE, а состав жидкой фазы – от точки 1 до точки С. Содержание углерода в оставшемся жидком растворе увеличивается с понижением температуры и при 1147°С становится равным эвтектическому, т.е. 4,3%. Жидкий раствор ЖР4,3% С претерпевает эвтектическое превращение 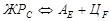 . При температуре между линиями ECF и PSK сплав имеет структуру А + Л(А + ЦI) + ЦII. Вторичные
. При температуре между линиями ECF и PSK сплав имеет структуру А + Л(А + ЦI) + ЦII. Вторичные
12
превращения в доэвтектическом белом чугуне на I этапе связаны с уменьшением растворимости углерода в аустените по мере снижения температуры по линии ES, из аустенита выделяется цементит вторичный (ЦII). При 727°С аустенит достигает эвтектоидной концентрации с содержанием углерода 0,8% и далее на II этапе происходит эвтектоидное превращение 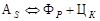 . Структура доэвтектического белого чугуна будет П + Л(П + ЦI) + ЦII. Вторичный цементит сливается с цементитом ледебурита.
. Структура доэвтектического белого чугуна будет П + Л(П + ЦI) + ЦII. Вторичный цементит сливается с цементитом ледебурита.
Эвтектический белый чугун (сплав IV, см. рис. 1 и рис. 3, а), имеющий концентрацию углерода 4,3%, кристаллизуется при постоянной температуре 1147°С в точке С (в интервале точек I – I’ (см. рис. 3, а) с образованием ледебурита Л (А + ЦI). Эвтектическая реакция образования ледебурита идет по всей линии ECF.
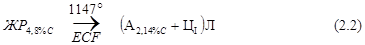
Вторичные превращения в сплаве (превращения в твердом состоянии) происходят в два этапа. Ш этап: между точками 1’ и 2 в процессе охлаждения сплава от 1147 до 727°С из аустенита А2,14% С в составе ледебурита Л(А + ЦI) выделяется цементит вторичный ЦII, так как растворимость аустенита по мере охлаждения изменяется.
При 727°С (в точке 2, см. рис. 3, а) концентрация углерода в аустените становится равной эвтектоидной, т.е. 0,8%, и в интервале точек 2 – 2’ (см. рис. 3, а). происходит второй этап – эвтектоидное превращение аустенита А0,8%С 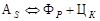 . Ниже 727°С структура сплава – эвтектического белого чугуна будет Л(П + ЦI + ЦII).
. Ниже 727°С структура сплава – эвтектического белого чугуна будет Л(П + ЦI + ЦII).
При охлаждении сплавов, содержащих углерода от 4,3 до 6,67% (сплав VI, см. рис. 1 и рис. 2, в) в точке 1 начинается кристаллизация цементита первичного ЦI, так как жидкий раствор богат углеродом. С понижением температуры по мере кристаллизации ЦI содержание углерода в жидком растворе уменьшается и при 1147°С (точка 2 на рис. 3, в) становится равным эвтектическому, т.е. 4,3%. Далее происходит эвтектическая кристаллизация оставшегося количества жидкого раствора ЖР4,3% С по реакции (2.2). Ниже 1147°С (I этап, см. рис. 3, в) происходят вторичные превращения в заэвтектическом белом чугуне. При поинжении температуры (точки 2’ – 3 на рис. 3, в) из аустенита, входящего в ледебурит Л(А + ЦI), выделяется цементит
13
вторичный ЦII, концентрация углерода в аустените уменьшается и при 727°С достигается 0,8%, т.е. эвтектоидной концентрации. Структура белого заэвтектического чугуна на I этапе ЦI + Л(А + ЦII) + ЦII.
При 727°С (точка 3 на рис. 3, в) начинается II этап – разложение аустенита А0,8% С по реакции (2.1) на феррит и цементит вторичный ЦII. Структура заэвтектического белого чугуна ниже 727°С будет состоять из ЦI + Л(П + ЦI) + ЦII.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы Fe–Fe 3 C, т.е. критические точки, обозначают буквой А (начальная буква французского слова arret – остановка). Первая критическая точка А1 лежит на линии PSK (727°С) и соответствует превращению 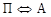 ; А2 – линия МО (768°С), при этой температуре происходит магнитное превращение феррита; А3 – линия GOS, по этой линии происходит превращение
; А2 – линия МО (768°С), при этой температуре происходит магнитное превращение феррита; А3 – линия GOS, по этой линии происходит превращение 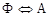 , температура которого зависит от содержания углерода в стали; А4 – линия NJ – превращение
, температура которого зависит от содержания углерода в стали; А4 – линия NJ – превращение 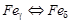 ; А С м – линия SE, начало выделения ЦII (иногда эту точку обозначают и как А3). Поскольку превращения совершаются при нагреве и охлаждении при различных температурах вследствие теплового гистерезиса, чтобы отличить эти процессы, ввели дополнительные обозначения. При нагреве обозначают Ас 1, Ас 3, при охлаждении – Аr 1, Аr 3 (начальные буквы от французских слов – chauffe – нагрев и refroidissement – охлаждение).
; А С м – линия SE, начало выделения ЦII (иногда эту точку обозначают и как А3). Поскольку превращения совершаются при нагреве и охлаждении при различных температурах вследствие теплового гистерезиса, чтобы отличить эти процессы, ввели дополнительные обозначения. При нагреве обозначают Ас 1, Ас 3, при охлаждении – Аr 1, Аr 3 (начальные буквы от французских слов – chauffe – нагрев и refroidissement – охлаждение).
III. СОДЕРЖАНИЕ ОТЧЕТА
1. Тема лабораторной работы.
2. Цель работы.
3. Краткие теоретические сведения.
4. В определенном масштабе необходимо выполнить диаграмму состояния сплавов Fe – Fe 3 C и кривые охлаждения железоуглеродистых сплавов, дать пояснения происходящих при этом фазовых превращений.
 14
14
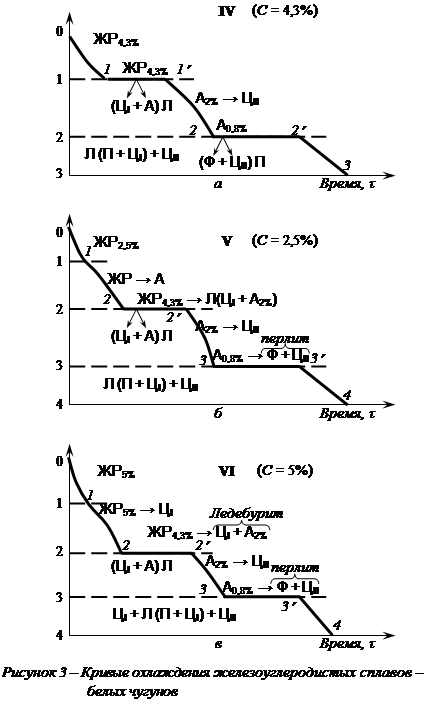 15
15
16
ЛИТЕРАТУРА
1. Кнорозов Б.В., Усова Л.Ф., Третьяков А.В., Китаев Н.А., Филькин В.М., Шевченко А.А., Усов Г.А. Технология металлов и материаловедение. – М.:Металлургия, 1987. – 800с.
2. Болковитинов Н.Ф. Металловедение и термическая обработка. –М.:Машиностроение, 1965. – 503с.
3. Лахтин Ю.М. Металловедение и термическая обработка. – М.:Металлургия, 1983. – 359с.
|
|
|


