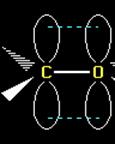
|
Как определить тип гибридизации?
|
|
|
|
Длина, энергия (прочность) и полярность связи.
Длина связи – расстояние между ядрами атомов в соединении.
Она зависит:
А) от радиусов атомов, образующих связь
Б) от кратности связи (одинарная, двойная, тройная).
Обычно чем короче связь, тем она прочнее.
Связь считается прочной, если ее энергия превышает 500 кДж/моль (например, 942 кДж/моль для N2), слабой - если ее энергия меньше 100 кДж/моль (например, 69 кДж/моль для NO2).
| HF | HCl | HBr | HI | |
| Длина связи, пм | ||||
| Энергия связи, кДж/моль |
Чем больше кратность связи, тем она прочнее:
тройная>двойная >одинарная.
Энергии связей между атомами углерода.
| Связь | Энергия (кДж/моль) |
| С-С | |
| С=С | |
| С≡С |
Полярность ковалентной связи
Полярность химической связи зависит от разности электроотрицательностей связываемых атомов.
Чем больше разность электроотрицательностей двух атомов в связи, тем она более полярная.
Для ионной связи существует понятие степень ионности, которое тоже зависит от того, насколько велика разность электроотрицательностей атомов.
 Между двумя атомами в химической частице возможна только одна σ-связь.
При перекрывании параллельных друг другу атомных орбиталей перпендикулярно оси связи образуются π-связи.
Между двумя атомами в химической частице возможна только одна σ-связь.
При перекрывании параллельных друг другу атомных орбиталей перпендикулярно оси связи образуются π-связи.
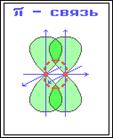 Пи-связь: дополнительная к сигма связи. Одинарная связь – всегда сигма-связь. Двойная связь – состоит из 1 сигма и 1 пи-связи.
Тройная связь: 1 сигма и 2 пи-связи.
Пи-связь: дополнительная к сигма связи. Одинарная связь – всегда сигма-связь. Двойная связь – состоит из 1 сигма и 1 пи-связи.
Тройная связь: 1 сигма и 2 пи-связи.
| Одинарная (σ) | Двойная (σ+π) | Тройная (σ + π + π) |
| С–С С–Н С–О H–Cl | С=O С=С О=О | С≡С С≡N N≡N |
|
|
|
Гибридизация
Если атом связан с другими атомами ОДИНАКОВЫМИ СВЯЗЯМИ, но при их образовании участвуют орбитали разного типа, то используется метод ГИБРИДИЗАЦИИ.
Пример: Молекула СН4 имеет форму правильного тетраэдра, в ней все 4 связи имеют одинаковую длину, прочность, находятся под одинаковыми углами друг к другу.
Однако у четырёхвалентного атома углерода электроны расположены на трёх р-орбиталях и одной s-орбитали. Они разные по энергии, форме и расположены в пространстве иначе.
Для объяснения используется понятие ГИБРИДИЗАЦИИ:
Из четырёх атомных орбиталей образуются 4 новых,
гибридных орбитали, которые в пространстве располагаются НА МАКСИМАЛЬНОМ УДАЛЕНИИ ДРУГ ОТ ДРУГА. Это правильный тетраэдр, углы между связями равны 109° 29´.

Так как в образовании четырёх связей участвуют одна s и три р-оболочки, то такой тип гибридизации обозначается sp3
В зависимости от числа и типа орбиталей, которые принимают участие в гибридизации, отличают следующие типы гибридизации:
1) sp-гибридизация. Участвуют одна s-орбиталь и одна р-орбиталь. Молекула имеет линейную структуру, валентный угол – 1800.

2) sp2-гибридизация. Участвуют одна s-орбиталь и две р-орбитали. Молекула располагается в плоскости (концы гибридных орбиталей направлены к вершинам равностороннего треугольника), валентный угол – 1200.

3) sp3-гибридизация. Участвуют одна s-орбиталь и три р-орбитали. Молекула имеет тетраэдрическую форму, валентный угол – 109,280.

Как определить тип гибридизации?
1. В гибридизации участвуют сигма-связи и НЕПОДЕЛЁННЫЕ ИОННЫЕ ПАРЫ.
2. Общее число участвующих орбиталей сигма-связей + электронных пар = числу гибридных орбиталей и определяет тип гибридизации.
|
|
|
Задание: определить тип гибридизации атома углерода в молекуле фосгена.
O=C – Cl
\
Cl
1) углерод образует 2 одинарные связи (это сигма-связи) и одну двойную связь (сигма+пи).Все 4 электрона углерода участвуют в образовании этих связей.
2) таким образом, в гибридизации примут участие ТРИ СИГМА-связи. Это sp2- гибридизация, молекула имеет форму плоского треугольника. Пи-связь располагается перпендикулярно плоскости этого треугольника.