 |
Восстановление карбонильных соединений.
|
|
|
|
Альдегиды, кетоны, сложные эфиры карбоновых кислот легко восстанавливаются до спиртов. В качестве восстановителей используют боргидрид натрия (NaBH4) в спирте, литийалюминий гидрид (LiAlH4) в эфире, а также каталитическое восстановление водородом над никелевым, платиновым или палладиевым катализатором. При этом из альдегидов и сложных эфиров получаются первичные спирты, а из кетонов получаются вторичные спирты:

Физические свойства
Спирты до С10 при нормальных условиях являются жидкостями. Начиная с С11 и выше спирты, при нормальных условиях, являются твердыми веществами. Спирты С1 - С2 смешиваются с водой во всех отношениях и имеют характерный запах. По мере увеличения молекулярной массы растворимость спиртов в воде понижается. Твердые спирты лишены запаха и почти не растворимы в воде. Жидкие спирты являются хорошими растворителями многих органических веществ. Температура кипения спиртов возрастает по мере увеличения молекулярной массы. Спирты нормального строения кипят при более высокой температуре, чем спирты изомерного строения. При одинаковом количестве углеродных атомов первичные спирты кипят при более высокой температуре, чем вторичные, а вторичные кипят при более высокой температуре, чем третичные. Температура кипения спиртов значительно выше, чем температура кипения углеводородов и их галогенопроизводных. Это отличие обусловлено способностью спиртов к ассоциации, за счет образования водородных связей между протоном гидроксильной группы одной молекулы спирта и атомом кислорода другой молекулы. Спирты – ассоциированные жидкости.
Химические свойства
Химические свойства спиртов обусловлены присутствием гидроксильной группы –ОН. Реакции с участием этой группы протекают либо с разрывом связи С-О, либо с разрывом связи О-Н.
|
|
|
Реакции с разрывом связи О-Н
Кислотно-основные свойства
Спирты являются амфотерными соединениями. Они способны выступать в роли как кислот, так и оснований.
Диссоциацией по связи О-Н, спирты проявляют себя как типичные кислоты Бренстеда:

Соответственно спирты способны взаимодействовать со щелочными и щелочноземельными металлами (магний) с замещением атома водорода гидроксильной группы на катион металла. При этом выделяется водород (в момент выделения «in sity» атомарный и поэтому очень активный) и образуется алкоголят:

Алкоголяты легко гидролизуются:

Кислотные свойства спиртов понижаются в ряду метиловый, первичный, вторичный, третичный, что обусловлено электронодонорными свойствами алкильных групп, понижающих стабильность аниона.
Свойства оснований спирты проявляют по отношению как к кислотам Бренстеда, так и к кислотам Льюиса. Донорным атомом в молекуле спирта является атом кислорода. Кислоты Бренстеда протонируют атом кислорода гидроксильной группы:
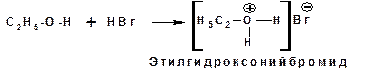
Кислоты Льюиса образуют со спиртами донорно-акцепторные комплексы, в которых атом кислорода выступает в роли донора неподеленной электронной пары:
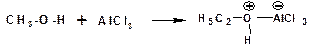
Спирты являются слабыми основаниями. Основные свойства возрастают в ряду: метиловый, первичный, вторичный, третичный, что обусловлено электронодонорными свойствами алкильных групп.
Этерификация
Спирты взаимодействуют с минеральными и органическими кислотами с образованием соответствующих сложных эфиров и воды:



Эфиры неорганических кислот получаются при взаимодействии спиртов и хлорангидридов неорганических кислот:

Образование уксусноэтилового эфира:
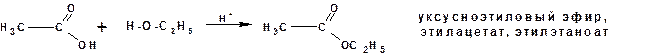
Дегидратация
При действии на спирты водоотнимающих веществ происходит межмолекулярное и внутримолекулярное отщепление воды. Водоотнимающими веществами являются кислоты: серная, фосфорная, щавелевая, беннзолсульфокислота; оксиды металлов: оксид алюминия, оксид тория.
|
|
|
При межмолекулярной дегидратации образуются простые эфиры. Механизм реакции включает две стадии. На первой стадии образуется сложный эфир, который на второй стадии вступает в реакцию нуклеофильного замещения со второй молекулой спирта:

В случае внутримолекулярной дегидратации спиртов, протекающей при более высокой температуре, от сложного эфира минеральнлй кислоты отщепляется кислота с образованием непредельного соединения. В этом случае на второй стадии протекает реакция элиминирования:

При этом водород отщепляется в соответствии с правилом Зайцева, с образованием наиболее алкилированного олефина.
Эта закономерность в сочетании с правилом Марковникова дает возможность переходить от одних спиртов к другим. Например, от изобутилового к третичному бутиловому спирту:

1.4.1.4. Реакции с галогеналканами.
Спирты являются слабыми нуклеофилами поэтому практически не реагируют с галогеналканами. Исключение составляют аллил и бензилгалогениды и некоторые третичные галогенпроизводные. Реакции протекают по механизму SN1.
Алкоксид-анионы являются сильными нуклеофилами и основаниями и способны реагировать с галоидными алкилами по механизму SN2:

|
|
|


