 |
Массовая и объёмная доли компонентов в смеси
|
|
|
|
| На предыдущем занятии мы узнали, что все вещества делятся на чистые вещества и смеси. В химии для изучения в основном используются чистые вещества, которые получают путем химического анализа из смесей. |
| В зависимости от агрегатного состояния смеси бывают жидкие, твердые и газообразные. |
| Жидкие смеси однородного состава также называют растворами. Для анализа веществ необходимо знать содержание растворенного в растворе вещества. Оно выражается с помощью массовой доли. |
| Рассмотрим, каким образом рассчитывается массовая доля растворенного вещества в растворе. Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества. |
Массовую долю обозначают латинской буквой w («дубль-вэ») и выражают в долях единицы или процентах: w (в долях) = m (вещество) / m (раствор), w (в %) = w * 100%.
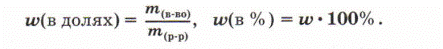 массовая доля равна отношению масс вещества к массе раствора. Массовая доля измеряется в долях, или в процентах, для этого нужно массовую долю умножить на сто процентов 100%.
Например:
1) Массовая доля растворенного вещества - серной кислоты равна 0,1 или 10%. Это означает, что в растворе серной кислоты массой 100 грамм содержится серная кислота массой 10 грамм и вода массой 90 грамм.
2) Или возьмем используемую в производстве бронзу, которая состоит из олова и меди. Массовая доля олова в сплаве равна 0,2 или 20%. Значит, в сплаве бронза массой 100 грамм содержится 20 грамм олова и 80 грамм меди.
массовая доля равна отношению масс вещества к массе раствора. Массовая доля измеряется в долях, или в процентах, для этого нужно массовую долю умножить на сто процентов 100%.
Например:
1) Массовая доля растворенного вещества - серной кислоты равна 0,1 или 10%. Это означает, что в растворе серной кислоты массой 100 грамм содержится серная кислота массой 10 грамм и вода массой 90 грамм.
2) Или возьмем используемую в производстве бронзу, которая состоит из олова и меди. Массовая доля олова в сплаве равна 0,2 или 20%. Значит, в сплаве бронза массой 100 грамм содержится 20 грамм олова и 80 грамм меди.
|
| Рассмотрим вычисление массовой доли при решении задач. |
| Задача 1. Для приготовления раствора сульфата меди (II) CuSO4 использовали 50 грамм соли и 450 грамм воды Н2О. Необходимо определить массовую долю сульфата меди (II) CuSO4 в полученном растворе. Дано. Масса сульфата меди (II) равна 50 грамм. Масса воды равна 450 грамм. Найти массовую долю сульфата меди (II) в растворе. Решение. Масса всего раствора равна (m (раствор)) сумме массы сульфата меди (II) и массы воды: m (раствор) = m (CuSO4) + m (Н2О) = 50 грамм + 450 грамм = 500 грамм. Зная массу раствора, по рассмотренной нами формуле, находим массовую долю сульфата меди (II) CuSO4 в растворе: w (CuSO4) = m (CuSO4) / m (раствора) = 50 грамм/500 грамм = 0,10 (10%). Ответ: массовая доля сульфата меди (II) CuSO4 в растворе составляет одну десятую, или десять процентов 10%. |
| Задача 2. Сколько граммов воды и сульфида бария BaSнужно взять для приготовления 120 грамм 10%-го раствора (0,10 в долях)? Дано. Масса раствора сульфида бария равна 120 грамм. Массовая доля сульфида бария в растворе равна одной десятой раствора. Найти массу сульфида бария в растворе и массу воды в растворе. Решение. Вспомним формулы, приведенные ранее, которые мы будем использовать: 1) масса вещества равна массе раствора, умноженной на массовую долю вещества; 2) масса воды равна масса раствора минус масса вещества. Масса сульфида бария равна произведению массы всего раствора на массовую долю сульфида бария в растворе и составляет: m (BaS) = m (раствора) * w (BaS) = 120 грамм *0,10 = 12 грамм. Массу воды вычисляем по формуле: m (Н2О) = m (раствор) - m (BaS) = 120 грамм – 12 грамм = 108 грамм. Ответ: масса сульфида бария BaS равна 12 грамм, а масса воды равна 108 грамм. |
| Рассмотрим, как вычисляется объемная доля газообразного вещества в газовой смеси. Объемная доля газообразного вещества в газовой смеси обозначается греческой буквой φ («фи»). Для ее определения используется следующая формула: φ = V (вещество) / V (смесь). Из этой формулы получаем следующие формулы: V (вещество) = V (смесь) * φ, V (смесь) = V (вещество) / φ. Например: 1)В биогазе, который выделяется при гниении органических веществ, объемная доля газообразного вещества метана около 65%. Это означает, что в 100 литрах газа содержится 65 литров метана. 2) Второй пример. В выхлопном газе современного автомобиля содержится примерно 4% водяного пара. Это значит, что в 100 метрах кубических газа содержится около 4 метров кубических воды. |
| Задача 3. Сколько кубических метров азота можно получить из жидкого воздуха, если исходный объем воздуха равен 100 м3 при нормальных условиях, а объемная доля азота в воздухе составляет 0,78? Дано. Объем воздуха равен сто кубических метров. Объемная доля азота составляет 78 сотых. Нормальные условия. Найти объем азота. Решение. Находим объем азота по известной нам формуле: V (вещества) = V (смеси) * φ. V (N2) = V (воздуха) * φ = 100 м3 * 0,78 = 78 м3. Ответ: Объем азота равен 78 семьдесят восемь метров кубических. |
| Задача 4. Найти массу углекислого газа в 400 л воздуха при нормальных условиях, если известно, что объемная доля углекислого газа в воздухе составляет 2%. Дано. Объем воздуха равен четыреста литров. Объемная доля углекислого газа составляет два процента, или две сотых в долях. Нормальные условия. Найти массу углекислого газа. Решение. Массу углекислого газа можно найти по формуле: m (CO2) = M (CO2) * n (CO2 ). А количество вещества: n (CO2) = V (CO2) / Vm. Объем углекислого газа найдем по формуле, рассмотренной ранее: V (CO2) = V (воздуха) * φ = 400 л * 0,02 = 8 л. Находим количество вещества: n (CO2) = V (CO2) / Vm = 8 л / 22,4 л/моль = 0,36 моль. М (CO2) = 12+16*2 = 44 (г/моль). Теперь находим массу углекислого газа: m (CO2) = M (CO2) * n (CO2) = 44 г/моль * 0,36 моль = 15,84 г. Ответ: масса углекислого газа составляет пятнадцать целых восемьдесят четыре сотых 15,84 грамма. |
Домашнее задание: повт. П.24.
|
|
|
|
|
|
Решить задачи:
1. Вычислить массовую долю азота в нитрате кальция.
2. Для приготовления раствора сульфата меди (II) CuSO4 использовали 70 грамм соли и 530 грамм воды Н2О. Необходимо определить массовую долю сульфата меди (II) CuSO4 в полученном растворе.
3. Сколько граммов воды и сульфида бария BaS нужно взять для приготовления 150 грамм 10%-го раствора (0,10 в долях)?
4. Сколько кубических метров азота можно получить из жидкого воздуха, если исходный объем воздуха равен 150 м3 при нормальных условиях, а объемная доля азота в воздухе составляет 0,78?
|
|
|
5. Найти массу углекислого газа в 250 л воздуха при нормальных условиях, если известно, что объемная доля углекислого газа в воздухе составляет 2%.
|
|
|
Воспользуйтесь поиском по сайту:

©2015 - 2026 megalektsii.ru Все авторские права принадлежат авторам лекционных материалов. Обратная связь с нами...

