 |
Внутренняя энергия идеального газа пропорциональна массе газа и его термодинамической температуре.
|
|
|
|
Домашнее задание
Выучить теорию (лекция)
Внутренняя энергия идеального газа. Закон равномерного распределения энергии по степеням свободы молекул
При изучении механики нас интересовало движение тел. Теперь мы рассмотрим явления, связанные с изменением свойств покоящихся тел. Мы будем изучать нагревание и охлаждение воздуха, таяние льда, плавление металлов, кипение воды и т.д. Подобные явления называют тепловыми явлениями. Мы знаем, что при нагревании холодная вода сначала становится тёплой, а затем горячей. Вынутая из пламени металлическая деталь постепенно охлаждается. Воздух, окружающий батареи с горячей водой, нагревается и т.д. Словами «холодный», «тёплый», «горячий» мы обозначаем тепловое состояние тел. Величиной, характеризующей тепловое состояние тел, является температура. Приборы, служащие для измерения температуры называются термометрами. Первый жидкостный термометр был изобретён в 1631 г. французским физиком Ж.Реем.
Однако, научившись измерять температуру, люди не понимали, что именно они измеряют. Вопрос о том, что такое температура, оказался очень сложным. Чем, например, горячая вода отличается от холодной? В течение долгого времени на этот вопрос не было ясного ответа.
Сегодня мы знаем, что при любой температуре вода состоит из одних и тех же молекул. Тогда что именно изменяется в воде при увеличении её температуры?
Обратимся к опыту. Возьмём два куска сахара и один из них бросим в холодную воду, а другой – в кипяток. Мы увидим, что в горячей воде сахар растворится значительно быстрее. Растворение происходит из-за диффузии. Таким образом, диффузия при более высокой температуре происходит быстрее, чем при низкой. Но причиной диффузии является движение молекул. Значит, между скоростью движения молекул и температурой тела есть связь: в теле с большей температурой молекулы движутся быстрее. Например, средняя скорость молекул кислорода при 0ºС составляет 425 м/с, а при 20ºС она равна 440 м/с. подчеркнём, что температура определяется именно средней скоростью молекул.
|
|
|
Но температура зависит не только от средней скорости молекул. Так, например, кислород, средняя скорость движения молекул которого составляет 440 м/с, имеет температуру 20ºС, а азот при той же средней скорости молекул имеет температуру 16ºС. Меньшая температура азота обусловлена тем, что молекулы азота легче молекул кислорода. Таким образом, температура вещества определяется не только средней скоростью движения его молекул, но и их массой. Мы знаем величины, которые зависят как от скорости, так и от массы частицы. Это – импульс и кинетическая энергия. Учёными установлено, что именно кинетическая энергия молекул определяет температуру тела: температура является мерой средней кинетической энергии частиц тела; чем больше эта энергия, тем выше температура тела.
При повышении температуры тела скорость движения частиц увеличивается.
Беспорядочное движение частиц, из которых состоят тела, связанное с температурой тела называют тепловым движением.
Тепловое движение отличается от механического тем, что в нём участвует большое количество частиц, каждая из которых беспорядочно движется.
Термодинамика изучает тепловые свойства макроскопических систем, не обращаясь к микроскопическому строению тел, составляющих систему. Она строится на базе нескольких основных принципов — начал (законов) термодинамики, которые представляют собой обобщение известных многочисленных опытных данных. Теоретическим изучением свойств вещества занимается статистическая физика, которая дала обоснование законов термодинамики и определила границу их применения.
|
|
|
При изучении основ термодинамики необходимо помнить следующие определения.
Физическая система, состоящая из большого числа частиц — атомов или молекул, которые совершают тепловое движение, и взаимодействуя между собой, обмениваются энергиями, называется термодинамической системой.
Состояние термодинамической системы определяется макроскопическими параметрами, например удельным объемом, давлением, температурой.
Термодинамика рассматривает только равновесные состояния, т. е. состояния, в которых параметры термодинамической системы не меняются со временем.
Термодинамическим процессом называют переход системы из начального состояния в конечное через последовательность промежуточных состояний. Процессы бывают обратимыми и необратимыми.
Обратимым называют такой процесс, при котором возможен обратный переход системы из конечного состояния в начальное через те же промежуточные состояния, чтобы в окружающих телах не произошло никаких изменений. Обратимый процесс является физической абстракцией. Примером процесса, приближающегося к обратимому, является колебание тяжелого маятника на длинном подвесе. В этом случае кинетическая энергия практически полностью превращается в потенциальную, и наоборот. Колебания происходят долго без заметного уменьшения амплитуды ввиду малости сопротивления среды и сил трения.
Любой процесс, сопровождаемый трением или теплопередачей от нагретого тела к холодному, является необратимым. Примером необратимого процесса является расширение газа, даже идеального, в пустоту. Расширяясь, газ не преодолевает сопротивления среды, не совершает работы, но, для того чтобы вновь собрать все молекулы газа в прежний объем, т. е. привести в начальное состояние, необходимо затратить работу. Таким образом, все реальные процессы являются необратимыми.
Внутренняя энергия.
Мы знаем, что существует два вида механической энергии: потенциальная и кинетическая. Кинетической энергией тела обладают вследствие своего движения, потенциальной - вследствие своего взаимодействия с другими телами. Тепловое движение молекул также можно описать средней кинетической энергией их движения, и потенциальной энергией их взаимодействия друг с другом.
|
|
|
Энергию движения и взаимодействия частицы, из которых состоит тело, называют внутренней энергией тела U.
Тепловое движение молекул никогда не прекращается. Поэтому любое тело всегда обладает внутренней энергией. Внутренняя энергия тела зависит от его температуры. При нагревании тела, его внутренняя энергия увеличивается, при охлаждении уменьшается.
При изменении давления или удельного объема изменяются межмолекулярные расстояния, т. е. потенциальная энергия взаимодействия атомов или молекул тоже изменяется, а значит, изменяется и внутренняя энергия.
Изучение тепловых явлений показывает, что, на сколько в них уменьшилась механическая энергия тел, на столько же увеличивается их внутренняя энергия. Полная же энергия тел, равная сумме их механической и внутренней энергий, при любых процессах остаётся неизменной. В этом заключается закон сохранения энергии, распространённый на тепловые явления.
Энергия не возникает из ничего и не исчезает бесследно. Она может лишь переходить из одного вида в другой, сохраняя своё полное значение.
Внутренняя энергия идеального газа представляет собой среднюю кинетическую энергию теплового движения молекул.
Газ, состоящий из отдельных атомов, а не молекул, называют одноатомным. К одноатомным газам относят инертные газы — гелий, неон, аргон.
Средняя кинетическая энергия поступательного движения молекулы (одноатомной) равна 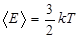 . Определим внутреннюю энергию идеального одноатомного газа массой m. Для этого среднюю энергию одного атома надо умножить на число атомов. В 1 моль содержится NA атомов, в газе массой m содержится ν = m/μ моль, поэтому внутренняя энергия идеального одноатомного газа
. Определим внутреннюю энергию идеального одноатомного газа массой m. Для этого среднюю энергию одного атома надо умножить на число атомов. В 1 моль содержится NA атомов, в газе массой m содержится ν = m/μ моль, поэтому внутренняя энергия идеального одноатомного газа
 или
или 
Внутренняя энергия идеального газа пропорциональна массе газа и его термодинамической температуре.
|
|
|


