 |
Получение соединений лития
|
|
|
|
Продуктами переработки литиевых концентратов являются соли лития (карбонат, сульфат, хлорид) и гидроксид. Наиболее распространенный конечный продукт - карбонат лития, который служит исходным материалом для получения других соединений, в частности хлорида лития, из которого производят металлический литий.
В промышленной практике преимущественно применяют три способа разложения литиевых концентратов:
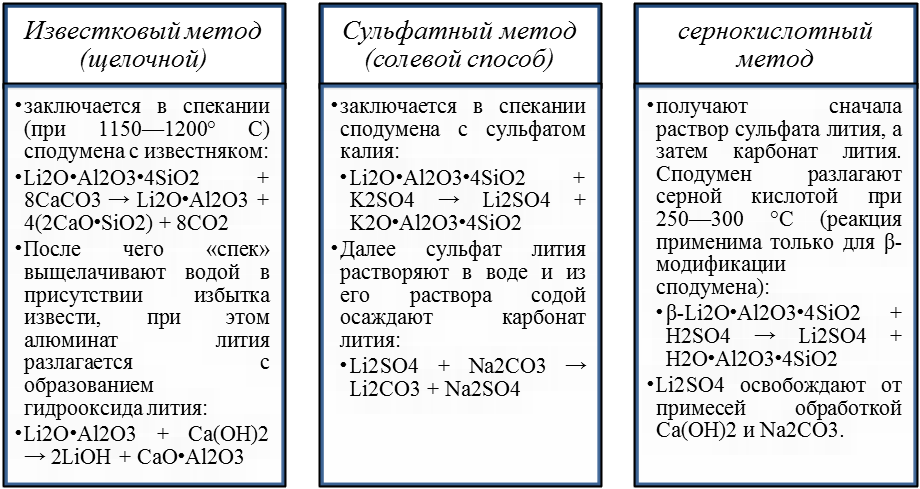
Рис.2 Способы разложения литиевых концентратов
Известковый способ применяют также при переработке лепидолитовых концентратов. В отличие от сподумена спекание лепидолита с известью (или мелом) проводят при более низкой температуре (900 - 950 °С).
К преимуществам известкового способа относятся его применимость к любым типам литиевых концентратов, возможность прямого получения гидроксида лития, дешевизна реагентов, возможность использования отходов (шлаков, содержащих силикаты и алюминаты кальция) для производства вяжущих строительных материалов, а также возможность попутного получения солей калия из маточных растворов.
Вместе с тем, способ имеет серьезные недостатки. Он преимущественно применим к богатым литиевым концентратам, однако и в этом случае извлечение в готовый продукт не превышает 70 %, что обусловлено ограниченной растворимостью гидроксида лития и способностью шламов после выщелачивания к схватыванию. Другой недостаток - необходимость выпаривания больших объемов растворов.
Сульфатный способ применяют также для переработки лепидолита и циннвальдита, различие лишь в дозировке сульфата калия в шихте и ниже температура спекания (850 - - 950 °С).
К преимуществам сульфатного способа переработки литиевого сырья относятся его универсальность и высокая степень вскрытия концентрата. Недостаток - высокий расход сульфата калия. Однако создание более рациональных схем переработки растворов, обеспечивающих высокую степень регенерации K2S04, позволит существенно улучшить экономические показатели процесса.
|
|
|
Сернокислотный метод используется при обработке руд, бедных сподуменом, если содержание в них Li2O не менее 1 %. Фосфатные минералы лития легко разлагаются кислотами, однако по более новым методам их разлагают смесью гипса и извести при 950—1 050 °C с последующей водной обработкой «спеков» и осаждением из растворов карбоната лития.
Все вышеперечисленные методы, кроме щелочного, предусматривают получение готового продукта в виде Li2CO3, используемого непосредственно и служащего источником для синтеза других соединений лития.
Производство лития
Металлический литий можно получать 2 способами электролитическим и металлотермическим. В настоящее время электролитический метод является достаточно эффективным и применяется в промышленных масштабах.
Получение лития электролизом
Металлический литий получают электролизом расплавленной смеси хлоридов лития (LiCl) и калия (KCl) при 400—460 °C, в среднем 420 °С (весовое соотношение компонентов близкое к эвтектическому 1:1).
Железные кожуха электролизных ванн футеруются магнезитом, алундом, муллитом, тальковым камнем, графитом и другими материалами, устойчивыми к расплавленному электролиту. Анодом служат графитовые, а катодом — железные стержни, катодное и анодное пространства разделены перегородкой из талькового камня. Графитированный анод и стальные катоды погружены в электролит сверху.
Электролиз проводят в электролите при соотношении LiCl: КС1 = 1:1 (по массе), что близко к составу эвтектики в системе LiCl - КС1, плавящейся при 361 °С. Это позволяет проводить электролиз при 400 - 460 °С.
|
|
|
На рис.2 показана принципиальная схема электролизера с двумя прикатодными пространствами, отделенными от анодного пространства диафрагмами. Стальной кожух ванны футеруют графитом - наиболее устойчивым материалом по отношению к хлориду лития. Однако и графит медленно взаимодействует с образованием карбида лития Li2C2, разлагающегося в электролите с выделением углерода. Графитовая футеровка и аноды в промышленных ваннах работают около трех месяцев.
Для получения лития более высокой чистоты применяют металлические злектолизеры с водоохлаждаемыми стенками, на которых образуется гарниссаж из застывших солей, защищающий электролит от взаимодействия с металлической стенкой.
Для расплавления электролита можно использовать внешний нагрев, в дальнейшем тепловой режим поддерживается теплом, выделяющимся при прохождении тока через электролит.
Катодами служат пластины из низкоуглеродистой стали, анодами - графитовые стержни. Потенциалы разложения LiCl и КС1 в электролите эвтектического состава при 400 °С равны 3,78 и 3,89 В соответственно, что обусловливает частичное выделение калия на катоде.

Рис 3. Схема электролизера для получения металлического лития
1 - графитовая футеровка; 2 - диафрагма из железной сетки; 3 - стальные катоды; 4 - жидкий литий; 5 - бункер для загрузки солей; 6 - отверстие для вычерпывания жидкого лития; 7 - диафрагма; 8 - графитоиый анод; 9 - стальной кожух ванны; 10 - камера для разогрева ванны; 11 - газовая горелка
Электролиз ведут при 400 - 430 °С при плотности тока на катоде и аноде 2,0 - 5,0 и 0,8 - 1,5 А/см2 соответственно. Выход по току достигает 90 - 93 %.
Выделяющийся на катоде жидкий литий всплывает на поверхность электролита, и его вычерпывают железной сетчатой ложкой по мере накопления. Металл защищен от окисления тонкой пленкой солей, хорошо смачивающих жидкий литий.
По ходу электролиза в анодное пространство периодически вводят LiCl, поддерживая в ванне его содержание 55 - 57 % (по массе). Примерное содержание примесей в электролитическом литии, %:Na 0,3 - 2,5; К 0,02 - 1,5; Си, Fe, Са - от 0,001 до 0,4; Si 0,004 - 0,8; А1 0,002 - 0,12; Mg 0,003; СІ 0,01.
Хлор из анодного пространства направляется в абсорбер, орошаемый известковым молоком.
|
|
|
Электролизом, помимо лития, можно получать сплавы лития с другими металлами (кальцием, магнием, тяжелыми металлами). Для этого либо вводят в электролит хлорид соответствующего металла, либо ведут электролиз с растворимым анодом из металла - компонента сплава с литием.
Литий получается в виде серебристо-белого слоя, плотно приставшего к катоду, выделяющийся на аноде хлор — ценный побочный продукт.
Чистота лития, получаемого электролизом, выше 99 %. Однако черновой металлический литий содержит механические включения и примеси (калий, магний, кальций, алюминий, кремний, железо, но главным образом натрий). Примесь натрия в литии отрицательно влияет на качество сплавов с литием, а также вредна при использовании лития в качестве катализатора в производстве синтетического каучука. Включения удаляются переплавкой, примеси — рафинированием при нагревании в вакууме.
Причем различают два вида рафинирования: отгонкой от чернового лития более легких летучих примесей и дистилляцией лития с последующей конденсацией его отдельно от примесей.
При применении первого способа в результате отгонки от лития при 300 °С содержание натрия удается снизить с 0,5 % до 0,13 %.
Однако более эффективен второй метод рафинирования: литий дистиллируют при 600 °С, а затем конденсируют при 340—420 °С; в результате чего в литии остается всего лишь 0,001 % натрия и несколько снижается содержание калия.
В Советском Союзе промышленный способ получения металлического лития электролизом впервые был осуществлен лишь в 1932—1934 гг. В настоящее время большое внимание уделяется металлотермическим методам
Литий выпускают в виде слитков, гранул, прутков, проволоки.
Получение лития металлотермическим способом
Для получения лития можно использовать недорогие исходные продукты - оксид или алюминаты лития. При металлотермии используется переменный ток, стоимость которого ниже стоимости постоянного тока низкого напряжения. Данное производство является практически безотходным так как, получаемые шлаки можно использовать в производстве электролиза алюминия. Этот способ составляет незначительную часть мирового производства лития. Это связано с низким содержанием лития в исходном сырье (алюминаты лития).
|
|
|
Для увеличения производительности аппаратов восстановления необходимо использовать более богатое по содержанию лития соединение – оксид лития, получаемый путем термической диссоциации карбоната лития.
Рассмотрим технологическую схему по получению металлического лития совмещенным процессом «диссоциация-восстановление»карбоната лития алюминием (Рис.4).
В результате анализа литературных данных при проектировании установки рекомендованы следующие технологические параметры.
1. Диссоциация карбоната лития:
- температура -от 700 до 740°С;
- время синтеза - 3 – 3,5 ч;
- остаточное давление - 15 – 20 Па;
- контрвакуум печного пространства - нет
2. Алюминотермическое восстановление оксида лития: 23
- температура - 940 - 950°С;
- время восстановления - 2 – 2,5 ч;
- остаточное давление - 10 – 15 Па;
- контрвакуум печного пространства - 13,3 кПа;
3. Алюминотермическое восстановление смеси алюминатов лития:
- температура - 1200 - 1250°С;
- время восстановления - 3 – 3,5 ч;
- остаточное давление - 1,3 – 10 Па;
- контрвакуум печного пространства - 10 кПа;

Рис. 4 Технологическая схема получения лития совмещенным процессом
«диссоциация-восстановление» карбоната лития
Для получения лития алюминотермическим восстановлением оксида лития в вакууме в качестве аппарата – аналога взята вакуумная шахтная ретортная печь для дистилляции кальция из медно-кальциевого сплава.
|
|
|


