 |
Депонирование и мобилизация жиров.
|
|
|
|
Обмен и функции липопротеинов.
Поскольку жиры нерастворимы в воде и жидкостях организма, для транспорта этих веществ с кровью необходимы специальные механизмы. Транспорт осуществляется в составе особых частиц – липопротеинов.
Классификация липопротеинов.
Существует несколько классификаций липопротеинов, основанных на различиях в их свойствах: скорости флотации, ЭФ подвижности, а также на различиях в апопротеиновом составе частиц. Наибольшее распространение получила классификация, основанная на поведении ЛП в процессе ультрацентрифугирования. Согласно этой классификации различают хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). Различная ЭФ подвижность по отношению к глобулинам плазмы положена в основу другой классификации ЛП, согласно которой различают ХМ (остаются на линии старта подобно g-глобулинам), b-ЛП, пре-b-ЛП и a-ЛП, занимающие положение b-, a1- и a2-глобулинов, соответственно.
Строение ЛП.
Плазменные ЛП имеют сферическую форму. Внутри находится жировая “капля”, содержащая неполярные липиды (ТАГ, ЭХС) и формирующая ядро ЛП-частицы. Оно окружено оболочкой из ФЛ, НЭХС и белка. Этот поверхностный гидрофильный слой защищает гидрофобное ядро от водной среды, а также обеспечивает растворимость и транспорт ЛП-частиц в водной среде.
В составе ЛП обнаружено несколько разных белков – апопротеинов: А-I, А-II, А-IV, В-48, В-100, С-I, С-II, С-III, D, E. Для всех этих белков характерно наличие гидрофильной и гидрофобной частей. Гидрофильная часть контактирует с плазмой крови, гидрофобная – с липидами ядра ЛП.
Образование и функции ЛП.
|
|
|
ЛП образуются в клетках слизистой оболочки кишечника (ХМ и ЛПВП), в гепатоцитах (ЛПОНП и ЛПВП), в плазме крови (ЛППП и ЛПНП).
Механизмы образования ХМ и ЛПОНП имеют много общего. Апопротеин В синтезируется рибосомами в шероховатом эндоплазматическом ретикулуме и встраиваются в ЛП в гладком эндоплазматическом ретикулуме, который является основным местом синтеза ТАГ. Затем ЛП прозодят через аппарат Гольджи и освобождаются из клетки в лимфу или кровь путем экзоцитоза.
ХМ и ЛПОНП служат для транспорта жиров по кровяному руслу (за сутки они распределяют по органам и тканям 70-150 г экзогенных и эндогенных жиров), а ЛПНП и ЛПВП – для транспорта холестерина. Жиры, образующиеся в печени, упаковываются в ЛПОНП, которые поступают в кровь. Печень взрослого человека выделяет в кровь 25-50 г жиров в сутки.
Жиры, синтезирующиеся в клетках кишечника из продуктов переваривания, в этих же клетках включаются в ХМ. ХМ поступают в лимфатические капилляры кишечника, затем через лимфатические сосуды брыжейки в грудной лимфатический проток и оттуда через яремную вену в общий кровоток. Ввиду своих размеров ХМ и ЛПОНП не способны выходить из кровяного русла и проникать в межклеточное пространство. Поэтому они сначала катаболизируются под действием липопротеинлипазы (ЛПЛ), локализованной на стенках капилляров ряда органов (жировой ткани, сердца) до менее крупных частиц, называемых соответственно ремнантами ХМ и ЛППП. Для проявления активности ЛПЛ требуется апопротеин С-II. ЛПЛ гидролизует ТАГ липопротеинов, при этом освободившиеся жирные кислоты поступают в клетки жировой и мышечной тканей или связываются с альбуминами и транспортируются к отдаленным органам. Ремнанты ХМ узнаются специфическими рецепторами печени по апопротеину Е и захватываются гепатоцитами. Здесь происходит распад белкового компонента и освобождение липидов, обогащенных НЭХС.
|
|
|
ЛППП либо узнаются рецепторами ЛПНП по апо Е или апо В100 (маркерный апопротеин ЛПОНП) и захватываются периферическими клетками, либо подвергаются дальнейшему катаболизму под действием печеночной липазы (ПЛ), превращаясь в ЛПНП. ЛПНП узнаются специфическими рецепторами и захватываются клетками периферических органов. В клетках ЛПНП подвергаются распаду с выделением НЭХС. Последний на генетическом уровне вызывает репрессию гидроксиметилглутарил-КоА-редуктазы – ключевого фермента биосинтеза эндогенного ХС.
ЛПВП имеют сложное происхождение. Липидный компонент включает НЭХС и ФЛ, высвобождающиеся при липолизе ХМ и ЛПОНП, а также НЭХС, поступающий из периферических клеток. Основной апопротеин ЛПВП – апо А-1 синтезируется в печени и тонком кишечнике. Вновь синтезированные ЛПВП представлены фракцией ЛПВП3. Под действием ЛХАТ (лецитин-холестерол-ацилтрансферазы), входящей в состав ЛПВП, происходит этерификация ХС (для активации ЛХАТ требуется апо А-I) и ЛПВП3 превращаются при этом в ЛПВП2. ЛПВП2 под действием ПЛ могут снова превращаться в ЛПВП3, либо захватываться путем эндоцитоза клетками печени.
Депонирование и мобилизация жиров.
Жиры депонируются в специализированных клетках жировой ткани – адипоцитах. Жир в жировой ткани накапливается за счет двух источников: поступает из липопротеинов и образуется из глюкозы в самих адипоцитах.
Мобилизация депонированных жиров происходит путем их гидролиза до жирных кислот и глицерина тканевыми липазами или триацилглицероллипазами. Мобилизацию депонированного жира активирует адреналин, действуя по тому же механизму, как и в случае мобилизации гликогена, т.е. через каскад реакций, включающий синтез цАМФ, активацию протеинкиназы и фосфорилирование тканевой липазы.
Жирные кислоты поступают в кровь, где образуют комплекс с альбумином и в такой форме транспортируется к органам и тканям. Глицерин транспортируется в растворенном состоянии и улавливается главным образом печенью. Здесь он превращается в глицерол-3-фосфат, который может вступать в реакции глюконеогенеза или окисляться в реакциях гликолиза и общего пути катаболизма.
Ожирение
Большая часть пищевых и синтезируемых в печени жиров проходит стадию депонирования в жировой ткани. У нормально упитанного человека жиры составляют около 15% массы тела. При полном голодании этот запас расходуется в течение 5-7 недель, т.к. его хватает на значительно большее время, чем запасов гликогена. При нормальном питании количество жира в организме здорового человека не изменяется. Однако и в этих условиях жиры жировой ткани постоянно обновляются. Другими словами одновременно и постоянно происходят депонирование и мобилизация жира с равными скоростями. В результате жиры жировой ткани за несколько дней обновляются полностью. При длительном голодании и систематических физических нагрузках скорость мобилизации жиров преобладает над скоростью депонирования, и количество депонированного жира уменьшается. Наоборот, если скорость мобилизации меньше скорости депонирования, то наступает ожирение.
|
|
|
Наиболее частая причина ожирения – несоответствие между количеством потребляемой пищи и энергетическими тратами организма. Такое несоответствие возникает при чрезмерном потреблении пищи, при гиподинамии и особенно при сочетании этих двух факторов.
Важную роль в регуляции потребления и катаболизма пищи играет эндокринная система, поэтому ожирение является характерным признаком многих эндокринных заболеваний.
Биосинтез фосфолипидов
Фосфоглицеролы – основные компоненты мембранных липидов – также синтезируются из диацилглицеролов, поэтому стадии, предшествующие образованию диацилглицеролов, у биосинтеза ТАГ и фосфолипидов общие. Для синтеза фосфолипидов необходим ЦТФ, который является лимитирующим фактором этого процесса.
Синтез фосфатидилэтаноламинов, фосфатидилхолинов и фосфатидилсеринов.
Сначала активируется остаточный спирт:
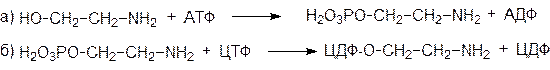
Остаток фосфоэтаноламина с ЦДФ-этаноламина затем переносится на глицериновый остаток диацилглицерола:
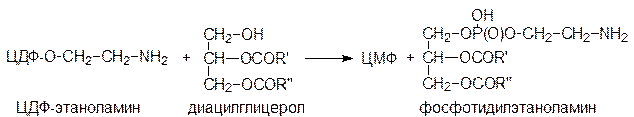
Аналогичная последовательность реакций, в которых вместо этаноламина тмпользуется холин, приводит к образованию фосфатидилхолина. Кроме того, фосфатидилхолин может образовываться путем метилирования фосфатидилэтаноламина с использованием метильных групп S-аденозилметионина:
|
|
|
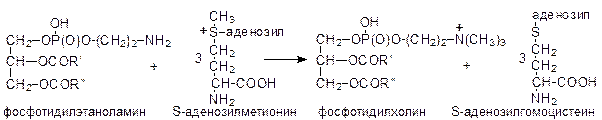
Фосфатидилсерин образуется в обменной реакции фосфатидилэтаноламина с серином:
фосфатидилэтаноламин + серин ® фосфатидилсерин + этаноламин
Синтезированные фосфолипиды переносятся с помощью липидпереносящих белков цитоплазмы к мембранам и встраиваются в них.
Обмен и функции стероидов
Основным стероидом организма человека является холестерин. Он выполняет в клетках структурную функцию, входя в состав клеточных мембран, а также является предшественником при синтезе желчных кислот, кортикостероидов, половых гормонов и витамина Д. В теле взрослого человека содержится содержится около 140 г ХС (~2 мг ХС на 1 г массы тела).
Наиболее богаты ХС нервная ткань (миелиновые мембраны) и кора надпочечников. Часть ХС тканей этерифицирована высшими жирными кислотами, обычно олеиновой кислотой. Эфиры холестерина – это, как правило, депонированная или транспортная форма ХС. Например, 75% ХС ЛП крови этерифицировано, 83% ХС этерифицировано в надпочечниках, где ЭХС депонируется в форме капель в цитоплазме. В большинстве других органов ЭХС составляет меньшую часть всего ХС. Например, в нервной ткани, где сосредоточено 20-25% всего ХС, почти 100% приходится на НЭХС.
С возрастом в плазме крови, в соединительной ткани, жировой ткани, коже, интиме артерий происходит увеличение содержания ХС, преимущественно за счет ЭХС.
Фонд ХС организма создается за счет ХС пищи и его синтеза в самом организме. При питании растительной пищей, в которой ХС мало, главное значение имеет синтез ХС.
Биосинтез холестерола
В принципе синтез ХС осуществляется в клетках почти всех органов и тканей, однако в значительных количествах – в печени (80%), стенке тонкой кишки (10%) и коже (5%).
Биосинтез ХС можно разделить на 3 стадии: 1 – биосинтез мевалоновой кислоты; 2 – образование сквалена из мевалоновой кислоты; 3 – циклизация сквалена и образование ХС.
Образование мевалоновой кислоты
Молекула мевалоновой кислоты в печени образуется из ацетильных остатков ацетил-КоА.
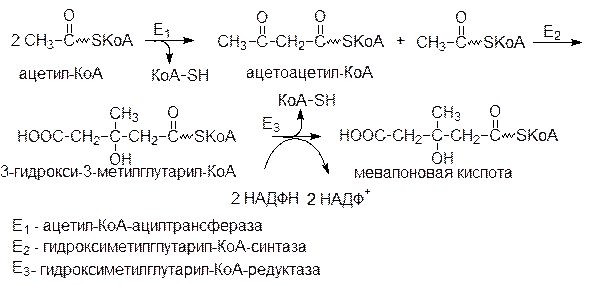
Общее количество ХС, синтезируемого в организме человека за сутки, достигает 500 мг.
Регуляция синтеза ХС
Скорость синтеза ХС регулируется по механизму отрицательной обратной связи. Основным пунктом регуляции является реакция образования мевлоновой кислоты – первая специфическая реакция пути синтеза ХС: ХС ингибирует ГМГ-КоА-редуктазу и подавляет ее синтез. При содержании 2-3 г ХС в суточной пище человека синтез собственного ХС почти полностью прекращается.
|
|
|
Транспорт холестерола
Как было указано выше, ХС синтезируется в клетках печени, кишечника и кожи. Другие органы и ткани получают его с кровью, поглощая ЛПНП путем эндоцитоза. Предотвращение избыточного накопления ХС в клетках обеспечивают ЛПВП. ЛПВП выступают в роли “уборщиков” свободного холестерола с поверхности клеток. Поступая в ЛПВП холестерол этерифицируется под действием ЛХАТ:
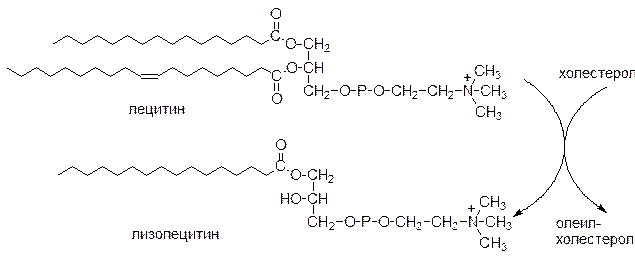
Образовавшиеся эфиры холестерола погружаются внутрь частицы. Вследствие этого концентрация холестерола в поверхностном слое уменьшается и освобождается место для поступления холестерола из других клеток. Т.о. гомеостаз холестерола в клетках разных органов поддерживается путем обмена холестерола между клетками и липопротеинами.
Биосинтез желчных кислот
В печени часть холестерола превращается в желчные кислоты. В гепатоцитах из холестерола образуются хенодезоксихолевая и холевая кислоты – первичные желчные кислоты. Их образование включает реакции введения гидроксильных групп при участии гидролаз и реакции частичного окисления боковой цепи ХС.
После выведения желчи в кишечник под действием ферментов кишечной флоры из первичных желчных кислот образуются вторичные желчные кислоты – литохолевая и дезоксихолевая кислоты. Они всасываются из кишечника, с кровью воротной вены попадают в печень, а затем в желчь.
В желчи содержатся в основном конъюгированные желчные кислоты, т.е. их комплексы с глицином или таурином. Боковая цепь с остатком глицина или таурина гидрофильна, в то время как другой конец молекулы (циклическая группировка) гидрофобна. Амфифильная природа желчных кислот обусловливает их поверхностно-активные свойства и участие в переваривании жиров.
Концентрация желчных кислот в желчи равна примерно 1%. В желчи содержатся также фосфолипиды (фосфатидилхолины, 0,5%), холестерин (0,5%), а также билирубин и минеральные соли. Следует отметить, что концентрация отдельных компонентов желчи непостоянна.
|
|
|


