 |
Опыт № 4. Взаимная коагуляция.
|
|
|
|
Приборы: пробирки, штатив для пробирок
Реактивы: 0,05 М раствор иодида калия  , 0,05 М раствор нитрата серебра
, 0,05 М раствор нитрата серебра 
Выполнение опыта. Взять две пробирки. В первую пробирку налить 5 мл раствора иодида калия и добавить несколько капель раствора нитрата серебра. Во вторую налить 5 мл раствора нитрата серебра и несколько капель раствора иодида калия. Получили коллоидные растворы, отличающиеся строением и зарядом гранулы.
Напишите уравнение реакции взаимодействия раствора иодида калия с раствором нитрата серебра.
Составьте формулы гранул при избытке и недостатке раствора нитрата серебра.
Полученные коллоидные растворы с противоположно заряженными гранулами слить в одну пробирку. Выпадает явный осадок, подтверждающий взаимную коагуляцию.
Контрольные вопросы
1. Дайте определение коллоидной системы. Назовите особенности коллоидного состояния.
2. Какое строение имеет двойной электрический слой?
3. Каково строение мицеллы?
4. Назовите основные методы получения коллоидных систем.
5. В чем сущность получения золей методом пептизации?
6. Что такое коагуляция? Какие факторы вызывают коагуляцию?
7. Дайте определение порога коагуляции.
8. Порог коагуляции отрицательно заряженного гидрозоля сульфида серебра под действием хлорида калия равен  моль/л. С помощью правила Шульце – Гарди рассчитайте пороги коагуляции, вызываемой следующими электролитами:
моль/л. С помощью правила Шульце – Гарди рассчитайте пороги коагуляции, вызываемой следующими электролитами: 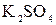 ,
,  ,
,  ,
,  ,
,  .
.
Лабораторная работа № 4. Определение адсорбционной активности глинистой фракции грунта в статических условиях.
Грунты – это трехфазные дисперсные системы, которые являются естественными ионообменными материалами. Твердая фаза грунтов представлена минеральными частицами и частицами органических соединений. Всякая дисперсная система обладает определенной поверхностной энергией, измеряемой произведением поверхностного натяжения, имеющегося на границе раздела двух фаз, на суммарную величину поверхности всех частиц дисперсной фазы.
|
|
|
 ,
,
где Е – свободная поверхностная энергия;  – поверхностное натяжение;
– поверхностное натяжение;  – площадь поверхности раздела фаз.
– площадь поверхности раздела фаз.
В большой зависимости от величины удельной поверхности и поверхностной энергии находится поглотительная способность грунтов. Экспериментально была изучена и показана огромная роль, которую играет поглотительная способность грунтов в процессах их укрепления.
Сумму поглощенных катионов, выраженную в миллиэквивалентах на 100 г грунта, называют емкостью поглощения или емкостьюобмена.
Обменные реакции в грунтах и состав поглощенных катионов обусловливают резкие изменения структуры грунтов, их прочности и физических свойств, важных в строительном отношении. Поэтому изучение ионообменных реакций в грунтах приобретает исключительно важное теоретическое и практическое значение при разработке и осуществлении различных методов укрепления грунтов.
Ионообменный процесс проводят в статических или динамических условиях. В статическом режиме к некоторому количеству грунта добавляют раствор электролита и оставляют стоять до достижения равновесия. Затем грунт отделяют от раствора, определяя обменную способность грунта.
В динамическом режиме грунт помещают в колонку. Пропускают раствор электролита до уравнивания концентрации исходного раствора и раствора элюента.
Цель работы: изучение адсорбционных и ионообменных процессов на глинистой фракции грунта.
Приборы: конические колбы на 250 мл, цилиндр на 100 мл, глинистая фракция грунта в воздушно-сухом состоянии, химические стаканы, воронки, бумажные фильтры, бюретки, пипетки на 5 мл.
|
|
|
Реактивы: растворы соли никеля с концентрациями – 0,05; 0,1; 0,2 и 0,5 моль/л, аммиачный буферный раствор (рН=10), индикатор – мурексид, 0,025 М раствор трилона Б (натриевая соль этилендиаминтетрауксусной кислоты).
Выполнение работы. Адсорбция ионов никеля проводится в статических условиях. В четыре сухие и пронумерованные колбы поместить по 10 г глинистой фракции грунта. Отмерить цилиндром и внести в колбы по 50 мл раствора соли никеля следующих концентраций: в первую – 0,05 М, во вторую – 0,1 М, в третью – 0,2 М и четвертую – 0,5 М.
Закрыть колбы пробками и перемешать содержимое колб с помощью специального встряхивателя в течение 20 мин. После этого растворы отфильтровать в отдельные, пронумерованные колбочки. Количество адсорбированных ионов никеля грунтом можно узнать, проанализировав количество никеля, оставшегося в фильтрате.
Для этого в отдельные колбы взять по 5 мл каждого фильтрата, добавить по 5 мл аммиачного буферного раствора и индикатор мурексид. Полученную смесь оттитровать 0,025 М раствором трилона Б прибавляя его по каплям из бюретки до появления сиреневого окрашивания. Результаты титрования занести в таблицу 4.4.
Таблица 4.4. Расчет величины адсорбции
| № п/п | С0, моль/л |  ,
мл ,
мл
| Ср, моль/л | 
| 
| 
| 
|
| 0,05 | |||||||
| 0,1 | |||||||
| 0,2 | |||||||
| 0,5 |
Концентрацию ионов никеля рассчитать по формуле:
 ,
,
где С – концентрация ионов никеля в растворе, моль/л;  - концентрация трилона Б 0,025 М;
- концентрация трилона Б 0,025 М;  - объем трилона Б, пошедший на титрование, мл;
- объем трилона Б, пошедший на титрование, мл;  - объем пробы раствора никеля на титрование, мл.
- объем пробы раствора никеля на титрование, мл.
Используя полученные данные, постройте изотерму адсорбции, откладывая по оси абсцисс значения  , а по оси ординат значение
, а по оси ординат значение  (где
(где  - масса адсорбента, г).
- масса адсорбента, г).
Зависимость адсорбции от концентрации растворенного вещества выражается эмпирическим уравнением Фрейндлиха:

где к и  - постоянные величины, определяемые опытным путем.
- постоянные величины, определяемые опытным путем.
Для нахождения постоянных величин прологарифмируем уравнение, получим
 .
.
Полученное уравнение имеет вид прямой линии. Отрезок на оси абсцисс от начала координат до начала прямой дает величину к, а тангенс угла наклона прямой дает величину  .
.
|
|
|
Контрольные вопросы
1. Что понимается под ионным обменом?
2. Объясните, что такое поглотительная способность грунтов?
3. Как зависит поглощаемая способность грунтов в зависимости от их минералогического состава?
4. Каким уравнением описывается процесс адсорбции на границе раздела твердое вещество – раствор?
5. Как зависит величина адсорбции от концентрации растворенного вещества?
6. В каких дисперсных минералах грунта ионный обмен, протекает быстро и в каких замедленно? Почему?
7. Как влияет изменение атомного веса и валентности катиона на ионообменное поглощение грунта?
8. Как протекает процесс поглощения анионов грунтами?
Лабораторная работа № 5. Адсорбция ионов никеля катионитом в динамических условиях
Цель работы: изучение ионообменных процессов ионов никеля на карбоксильном катионите КБ-4Пх2 в динамических условиях.
Приборы: адсорбционная колонка, тубус для раствора адсорбтива, мерные стаканы на 100 мл, пипетка на 5 мл, бюретка.
Реактивы: раствор соли сульфата никеля с концентрацией – 0,1 М, аммиачный буферный раствор (рН=10-12), индикатор – мурексид, 0,025 М раствор трилона Б (натриевая соль этилендиаминтетрауксусной кислоты), карбоксильный катионит КБ-4Пх2.
Выполнение работы. В колонку поместить по 3 г карбоксильного катионита КБ-4Пх2 в аммонийной форме. Из колонки удалить лишний раствор, оставив над катионитом не более 0,5 мм жидкости. Из тубуса с 0,1 М раствором сульфата никеля заполнить колонку над адсорбентом. Затем соединить отвод тубуса с колонкой резиновым шлангом, закрыв герметично отверстие колонки пробкой. Под кран колонки поместить мерный стакан и открыть кран. Раствор вытекает из колонки. Скорость фильтрации раствора устанавливается постоянной - 1 мл/мин или 3 капли за 5 секунд. Регулируется скорость фильтрации раствора при помощи крана.
Отбор фильтрата производить по 25 мл, до установления равновесного состояния (концентрация ионов в фильтрате становится равной исходной концентрации).
В каждой пробе фильтрата определить концентрацию ионов никеля трилонометрическим методом, по методике приведенной в работе 4. Полученные данные занести в таблицу 5.5.
|
|
|
Таблица 5.5. Расчет величины адсорбции ионов никеля
| № п/п | Исходная конц-я
р-ра
 ,
моль/л ,
моль/л
| Объем фильтрата
 , мл , мл
| Объем трилона Б
 , мл , мл
|  ,
моль/л ,
моль/л
|  = =
 ,
моль/л ,
моль/л
|  ,
моль/г ,
моль/г
|
| 1. | ||||||
| 2. | ||||||
| 3. |
Концентрацию ионов никеля рассчитать по формуле:
 ,
,
где С – концентрация ионов никеля в растворе, моль/л;  – концентрация трилона Б 0,025 моль/л;
– концентрация трилона Б 0,025 моль/л;  – объем трилона Б, пошедший на титрование, мл;
– объем трилона Б, пошедший на титрование, мл;  – объем пробы раствора никеля на титрование, мл.
– объем пробы раствора никеля на титрование, мл.
Удельную адсорбцию ионов никеля на карбоксильном катионите рассчитать по уравнению
 , моль/г
, моль/г
где  – объем фильтрата, мл;
– объем фильтрата, мл;  - масса адсорбента, г;
- масса адсорбента, г;  – изменение концентрации, моль/мл.
– изменение концентрации, моль/мл.
По полученным результатам построить изотерму адсорбции, откладывая по оси абсцисс объем фильтрата, пропущенного через колонку (мл) катионита, по оси ординат – концентрацию ионов никеля в фильтрате (моль/л).
По графику определить точку проскока, т.е. точку появления катионов никеля в фильтрате, и обменную емкость до проскока, рассчитав величину удельной адсорбции в этой точке.
Определить динамическую емкость (ДОЕ) адсорбента по формуле:

где  – количество проб фильтрата,
– количество проб фильтрата,  – величина сорбции в каждой пробе.
– величина сорбции в каждой пробе.
Контрольные вопросы
1. Что понимается под термином адсорбция в «динамических условиях»?
2. Количественная характеристика процесса адсорбции в динамических условиях.
3. Что такое изотерма адсорбции?
4. Как протекает поглощение газообразных веществ твердыми пористыми телами?
Лабораторная работа № 6. Вяжущие материалы на основе оксида кальция.
Неорганическими вяжущими строительными материалами называются минеральные порошкообразные материалы, способные при смешивании с водой образовывать пластичную массу, затвердевающую с течением времени в камневидное тело.
Классификация неорганических вяжущих.
По скорости твердения:
- быстротвердеющие (штукатурный гипс)
- медленнотвердеющие (портландцемент)
По отношению к воде:
- воздушные вяжущие, продукты твердения, которых устойчивы только на воздухе, а в воде теряют прочность и распадаются. Это воздушный и строительный гипс, ангидритовый цемент, магнезиальный цемент, растворимое стекло.
- гидравлические вяжущие, которые могут твердеть не только на воздухе, но и под водой, и продукт твердения, которых сохраняет свою прочность, как на воздухе, так и в воде. К ним относятся: портландцемент, пуццолановый, сульфатностойкий цементы, шлако-портландцемент, а также глиноземистый цемент.
|
|
|
Известь. Известь получают обжигом кальциево-магниевых карбонатных горных пород (известняков, мела, доломита). При термической диссоциации из них удаляется  и получается продукт, обладающий вяжущими свойствами:
и получается продукт, обладающий вяжущими свойствами:

В зависимости от количества примесей известь бывает:
- воздушная - примесей не более 6%;
- гидравлическая - примесей > 6%
В воздушной извести содержание свободных окислов  достигает 90-95%, а силикатов
достигает 90-95%, а силикатов  и алюминатов
и алюминатов  кальция не более 10%.
кальция не более 10%.
В гидравлической извести силикатов и алюминатов входит до 70-80%, а остальное  .
.
Гашением извести называется процесс взаимодействия ее с водой, при котором она превращается в гидрат.
 .
.
Процесс твердения извести заключается в карбонизации:
 .
.
Портландцемент. Портландцемент - это гидравлическое вяжущее вещество, твердеющее в воде и на воздухе. Является современным вяжущим строительным материалом.
Примерный состав портландцементного клинкера приведен в таблице 6.6.
Таблица 6.6. Примерный состав портландцементного клинкера
| Название минерала | Формула минерала | Условное обозначение минерала | Примерное содержание минерала в клинкере,% |
| Алит(трехкальцевый силикат) | 
| 
| 40 - 65 |
| Белит (двухкальцевый силикат) | 
| 
| 15 - 40 |
| Трехкальцевый алюминат | 
| 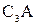
| 5 - 15 |
| Целит(четырехкальцевый алюмоферрит) | 
| 
| 10 - 20 |
При взаимодействии минералов цементного клинкера с водой протекают три основных процесса:
- Гидролитическое разложение минералов
гидролитическому разложению минералов подвергаются трехкальцевый силикат и четырехкальцевый алюмоферрит


- Частичный гидролиз
свободная молекула оксида кальция взаимодействует с водой с образованием гидроксида

- Образование кристаллогидратов



Схватывание и твердение цемента обусловлено сложным комплексом химических и физико-химических процессов. Процесс твердения цементного теста протекает в три стадии:
Первая стадия – затворение. Чаще эту стадию называют стадией насыщения. При взаимодействии воды с минералами цементного клинкера, она насыщается гидроксидом кальция  .
.
Вторая стадия – коллоидации. В результате взаимодействия с водой образуются гидросиликаты и гидроалюминаты кальция, обладающие малой растворимостью. При их образовании образуется коллоидный раствор, приобретающий структуру геля. Данная стадия отвечает процессу схватывания.
Третья стадия – стадия кристаллизации и твердения. На этой стадии из очень мелких частиц коллоидной системы образуются более крупные кристаллические частицы в результате кристаллизации. Такое разделение стадий носит условный характер.
Цель работы: ознакомление студентов со свойствами гидравлических и воздушных вяжущих материалов, основой которых является оксид кальция.
|
|
|


